Вычисления при обменных реакциях комплексных соединений. Заряды комплексных ионов
Задача 719.
Эмпирическая формула соли CrCl3 . 5H2O. Исходя из того, что координационное число хрома равно б, вычислить, какой объем 0,1 н. раствора AgNO3 понадобится для осаждения внешнесферно связанного хлора, содержащегося в 200 мл 0,01 М раствора комплексной соли; считать, что вся вода, входящая в состав соли, связана внутрисферно.
Решение:
Так как пять молекул воды, входящие в состав соли, связаны внутрисферно, и координационное число центрального атома хрома равно 6, то координационная формула соли будет иметь вид: [Cr(H2O)5Cl]Cl2. Во внешней сфере соли будет находиться два хлорид-иона, т.е. СЭ(Cl) = 2CM = 0,01 . 2 = 0,02 н.
Для расчета объёма раствора AgNO3 используем математическое выражение следствия из закона эквивалентов (так называемое правило пропорциональности):
CH(A) . V(A) = CH(B) . V(B)
где
Сн(A) и Cн(В) – молярные концентрации эквивалентов веществ А и В, моль; V(A) и V(B) – объёмы растворов веществ А и В.
Подставив данные задачи, вычислим объём раствора нитрата серебра, получим:
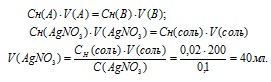
Ответ: 40 мл.
Задача 720.
Написать в молекулярной и ионно-молекулярной форме уравнения обменных реакций, происходящих между:
а) K4[Fe(CN)6] и CuSO4; б) Na3[Co(CN)6] и FeSO4; в) K3[Fe(CN)6] и AgNO3, имея в виду, что образующиеся комплексные соли нерастворимы в воде.
Решение:
а) Молекулярная форма:
K4[Fe(CN)6] + 2CuSO4 = Cu2[Fe(CN)6]↓ + 2K2SO4
Ионно-молекулярная форма (полная форма):
4K+ + [Fe(CN)6]4- + 2Cu2+ + 2SO42- = Cu2[Fe(CN)6]↓ + 4K+ + 2SO42-
После приведения членов в обеих частях равенства, получим:
[Fe(CN)6]4- + 2Cu2+ = Cu2[Fe(CN)6]↓
2Na3[Co(CN)6] +3FeSO4 = Fe3[Co(CN)6]2↓ + 3Na2SO4
Ионно-молекулярная форма (полная форма):
6Na+ + 2[Co(CN)6]3- + 3Fe2+ + 3SO42- = Fe3[Co(CN)6]2↓ + 6Na+ + 3SO42-
После приведения членов в обеих частях равенства, получим:
2[Co(CN)6]3- + 3Fe2+ = Fe3[Co(CN)6]2↓
K3[Fe(CN)6] + 3AgNO3 = Ag3[Fe(CN)6]↓ + 3KNO3
Ионно-молекулярная форма (полная форма):
3K+ + [Fe(CN)6]3- + 3Ag+ + 3NO3- = Ag3[Fe(CN)6]↓ + 3K+ + 3NO3-
После приведения членов в обеих частях равенства, получим:
[Fe(CN)6]3- + 3Ag+ = Ag3[Fe(CN)6]↓.
Задача 721.
Найти заряды комплексных частиц и указать среди них катионы, анионы и неэлектролиты: а) [Co(NH3)5Cl]; б) [Cr(NH3)4PO4]; в) [Ag(NH3)2]; г) [Cr(OH)6]; д) [Co(NH3)3(NO2)3]; е) [Cu(H2O)4].
Решение:
а) [Co(NH3)5Cl]. Заряды нона кобальта (III) +3, хрома (III), меди (II) и серебра принимаем равными соответственно +3, +3, +2, и +1; заряд молекулы аммиака и молекулы воды равен нулю, заряды хлорид-, нитрит-, гидроксид- и фосфат-ионов соответственно равны -1, -1, -1 и -3.
Составляем алгебраические суммы зарядов для каждого из указанных соединений, получим:
а) +3 + (-1) = +2 (катион); б) +3 + (-3) = 0 (неэлектролит); в) +1 = +1 (катион); г) +3+ 6(-1) = -3 (анион); +3 + 3(-1) = 0 (неэлектролит); е) +2 = +2 (катион).
Задача 722.
Определить степень окисленности комплексообразователя в следующих комплексных ионах: а) [Fe(CN)6]4-, б) [Ni(NH3)5Cl]+, в) [Co(NH3)2(NO2)4]-, г) [Co(H2O)4Br2]+, д) [AuCl4]-, е) [Hg(CN)4]2-, ж) [Cd(CN)4]2-.
Решение:
а) Определение степени окисленности комплексообразователя в [Fe(CN)6]4–.
Определяем степень окисленности железа, учитывая, что сумма зарядов частиц равна -4. Заряд CN равен -1. Тогда получим: х + 6(-1) = -4; х = -4 + 6; х = +2.
б) Определение степени окисленности комплексообразователя в [Ni(NH3)5Cl]+
Определяем степень окисленности никеля, учитывая, что сумма зарядов частиц равна +1. Заряд NH3 равен 0, а Cl равен -1.
Тогда получим: х + 5(0) + (-1) = +1; х = +1 + 1; х = +2.
в) Определение степени окисленности комплексообразователя в [Co(NH3)2(NO2)4]-
Заряд Со равен (х), NH3 – (0), NO2 – (-1). Отсюда, учитывая, что сумма зарядов частиц равна (-1), найдём заряд кобальта: х + 4(-1) + 2(0) = -1; х = +3. Степень окисленности равна +3.
г) Определение степени окисленности комплексообразователя в [Co(H2O)4Br2]+
Заряд Сr равен (х), H2O – (0), Br – (-1). Отсюда, учитывая, что сумма зарядов частиц равна (+1), найдём заряд хрома: х + 4(0) + 2(-1) = +1; х = +3. Степень окисленности равна +3.
д) Определение степени окисленности комплексообразователя в [AuCl4]-. Заряд Au равен (х), Cl - (-1). Отсюда, учитывая, что сумма зарядов частиц равна (-1), найдём заряд золота: х + 4(-1) = -1; х = +3. Степень окисленности равна +3.
е) Определение степени окисленности комплексообразователя в [Hg(CN)4]2-
Заряд Hg равен (х), CN - (-1). Отсюда, учитывая, что сумма зарядов частиц равна (-1), найдём заряд ртути: х + 4(-1) = -2; х = +2. Степень окисленности ртути равна +2.
ж)Определение степени окисленности комплексообразователя в [Cd(CN)4]2-
Заряд Сd равен (х), CN - (-1). Отсюда, учитывая, что сумма зарядов частиц равна (-1), найдём заряд кадмия: х + 4(-1) = -2; х = +2. Степень окисленности кадмия равна +2.

