Составление уравнений реакций окислительно-восстановительных процессов
Задача 637.
Закончить уравнения реакций, записать их в молекулярной форме:
а) С2O42- + I2 → CO2 +
б) BiO3- + Cr3+ + H+ → Cr2O72- +
в) SeO32- + I- + H2O → Se +
г) IO3- + SO2 + H2O →
Решение:
а) С2O42- + I2 → CO2 +
Уравнения полуреакций:
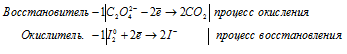
Ионно-молекулярная форма процесса:
С2O42- + I20 → 2CO2 + 2I-.
Молекулярная форма процесса
Na2C2O4 + I2 → 2CO2 + 2NaI.
б) BiO3- + Cr3+ + H+ → Cr2O72- +
Уравнения полуреакций:
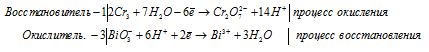
Ионно-молекулярная форма процесса:
3BiO3- + 2Cr3+ + 18H+ + 7H2O → 3Bi3+ + Cr2O72- + 14H+ + 9H2O.
После приведения членов в обеих частях равенства получим:
3BiO3- + 2Cr3+ + 4H+ → 3Bi3+ + Cr2O72- +2H2O.
Молекулярная форма процесса:
3KBiO3 + 2CrCl3 + 4HCl → 3BiCl3 + K2Cr2O7 + KCl + 2H2O
в) SeO32- + I- + H2O → Se +
Уравнения полуреакций:
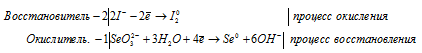
Ионно-молекулярная форма процесса:
SeO32- + 4I- + 3H2O → Se + 2I20 + 6OH-.
Молекулярная форма процесса:
K2SeO3 + 4KI + 3H2O → Se + 2I2 + 6KOH
г) IO3- + SO2 + H2O →
Уравнения полуреакций:
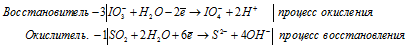
Ионно-молекулярная форма процесса:
3IO3- + SO2 + H2O → 3IO4- + S2- + 2H+
Молекулярная форма процесса:
K2IO3 + SO2 + H2O → 3KIO4 + H2S.
Задача 638.
Закончить уравнения реакций, записать их в молекулярной форме:
а) MnO4- + I- + H2O →
б) HPO32- + Hg2+ + H2O → Hg +
в) P + IO3- + OH- →
г) PCl3 + ClO3- + H2O →
д) AsO3- + I2 + H2O → AsO4- +
е) Bi3+ Br2 + OH- → BiO3- +
ж) Sb3+ + Zn + H+ → SbH3 +
Решение:
а) MnO4- + I- + H2O →
Уравнения полуреакций:
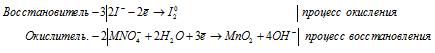
Ионно-молекулярная форма процесса:
MnO4- + 6I- + 4H2O → 2MnO2 + 3I20 + 8OH-.
Молекулярная форма процесса:
KMnO4 + 6KI + 4H2O → MnO2 + 3I2 + 8KOH.
б) HPO32- + Hg2+ + H2O → Hg +
Уравнения полуреакций:
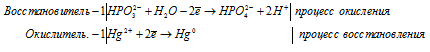
Ионно-молекулярная форма процесса:
HPO32- + Hg2+ + H2O → HPO42- + Hg0 + 2H+.
Молекулярная форма процесса:
Na2HPO3 + HgCl2 + H2O → Na2HPO4 + Hg + 2HCl.
в) P + IO3- + OH- →
Уравнения полуреакций:
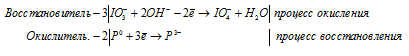
Ионно-молекулярная форма процесса:
2P + 3IO3- + 6OH- → 2P3- + 3IO4- + 3H2O.
Молекулярная форма процесса:
2P + 3KIO3 + 6KOH → 2PK3 + 3KIO4 + 3H2O.
г) PCl3 + ClO3- + H2O →
Уравнения полуреакций:
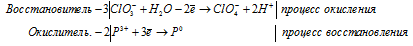
Ионно-молекулярная форма процесса:
3ClO3- + 2P3+ + 3H2O → 3ClO4- + 2P0 + 6H+
Молекулярная форма процесса:
2PCl3 + KClO3 + 3H2O → 2P + KClO4 + 6HCl.
д) AsO3- + I2 + H2O → AsO4- +
Уравнения полуреакций:
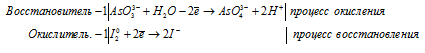
Ионно-молекулярная форма процесса:
AsO3- + I2 + H2O → AsO4- + 2I- + 2H+.
Молекулярная форма процесса:
Na3AsO3 + I2 + H2O → Na3AsO4 +2HI.
е) Bi3+ Br2 + OH- → BiO3- +
Уравнения полуреакций:
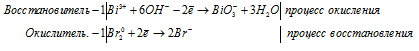
Ионно-молекулярная форма процесса:
Bi3+ Br2 + 6OH- → BiO3- + 2Br- + 3H2O.
Молекулярная форма процесса:
BiBr3 + Br2 + 6KOH → KBiO3 + 5KBr + 3H2O.
ж) Sb3+ + Zn + H+ → SbH3 +
Уравнения полуреакций:
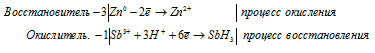
Ионно-молекулярная форма процесса:
Sb3+ + 3Zn0 + 3H+ → SbH3 + 3Zn2+
Молекулярная форма процесса:
SbCl3 + 3Zn + 3HCl → 3ZnCl2 + SbH3.

