Решение задач по химии на расчет степени диссоциации кислоты
Задача 507.
При какой концентрации раствора степень диссоциации азотистой кислоты HNO2 будет равна 0,2?
Решение:
Азотистая кислота HNO2 слабая, мала, поэтому пользуемся уравнением:
мала, поэтому пользуемся уравнением:
KD = CM .  2, где
2, где
KD – константа диссоциации кислоты, СМ – молярная концентрация кислоты,  - степень диссоциации кислоты.
- степень диссоциации кислоты.
Откуда
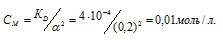
Ответ: 0,01 моль/л.
Задача 508.
В 0,1 Н. растворе степень диссоциации уксусной кислоты равна 1,32 . 10-2. При какой концентрации азотистой кислоты HNO2 ее степень диссоциации будет такой же?
Решение:
Подставим данные задачи в уравнение закона разбавления Оствальда:
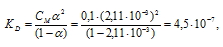
где
КD – константа диссоциации кислоты [KD(HNO2)], СМ – молярная концентрация кислоты,  - степень диссоциации кислоты.
- степень диссоциации кислоты.
Откуда
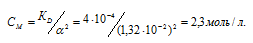
Ответ: 2б3 моль/л.
Задача 509.
Сколько воды нужно прибавить к 300 мл 0,2М раствора уксусной кислоты, чтобы степень диссоциации кислоты удвоилась?
Решение:
KD(CH3COOH) = 1,8 . 10-5. Поскольку уксусная кислота слабая, мала, поэтому для расчета пользуемся приближённым уравнением:
мала, поэтому для расчета пользуемся приближённым уравнением:
KD = CM .  2, где
2, где
KD – константа диссоциации кислоты, СМ – молярная концентрация кислоты,  - степень диссоциации кислоты.
- степень диссоциации кислоты.
Откуда
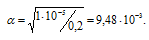
Учитывая, что степень диссоциации уксусной кислоты удвоилась, рассчитаем молярную концентрацию разбавленного раствора:
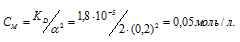
Рассчитаем количество кислоты, содержащейся в 300 мл О,2 М раствора её из пропорции:
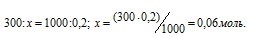
Теперь рассчитаем количество кислоты, содержащейся в 300 мл 0,5 М раствора её из
пропорции:
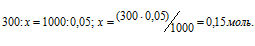
Рассчитаем объём раствора кислоты при разбавлении 300 мл 0,2М раствора с учётом того, что его концентрация станет равной 0,15М из пропорции:
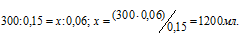
Теперь найдём объём воды добавленный для разбавления начального раствора кислот:
V = 1200 - 300 = 900 мл.
Ответ: 900 мл.
Задача 510.
Чему равна концентрация ионов водорода Н+ в водном растворе муравьиной кислоты, если  = 0,03?
= 0,03?
Решение:
KD(HCOOH) = 1,8 . 10-4. Из соотношения: KD = CM .  2, где
2, где
KD – константа диссоциации кислоты, СМ – молярная концентрация кислоты,  - степень диссоциации кислоты, получим:
- степень диссоциации кислоты, получим:
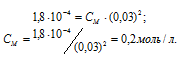
Рассчитаем концентрацию кислоты:
[H+] = . CM = 0,03 . 0,2 =
. CM = 0,03 . 0,2 =
= 0,006 = 6 . 10-3 моль/л.
Ответ: 6 . 10-3 моль/л.

