Решение задач по хими на вычисления с использованием значения произведения растворимости соли
Задача 563.
Исходя из произведения растворимости карбоната кальция, найти массу СаСО3, содержащуюся в 100 мл его насыщенного раствора.
Решение:
ПР(СаСО3) = 4,76 . 10-9.
Обозначим искомую растворимость соли СаСО3 через S моль/л. Тогда в насыщенном растворе соли содержится по S моль/л ионов Ca2+ и CO32-.
Выражение произведения растворимости карбоната кальция можно записать как:
ПР(СаСО3) =
= [Ca2+] . [CO32-] = S . S = S2.
Отсюда
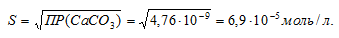
Теперь рассчитаем массу СаСО3 в 1 л насыщенного раствора его:
m(СаСО3) = S . M(СаСО3) =
= (6,9 . 10-5) . 100 = 6,9 . 10-2.
Находим массу СаСО3 в 100 мл насыщенного раствора его:
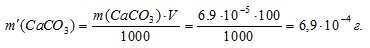
Ответ: 6,9 . 10-4 г.
Задача 564.
Найти массу серебра, находящегося в виде ионов в 1 л насыщенного раствора АgВг.
Решение:
ПР(АgВг) = 5,3 . 10-13.
Обозначим искомую растворимость соли АgВг. через S моль/л. Тогда в насыщенном растворе соли содержится по S моль/л ионов Ag+ и Br-.
Выражение произведения растворимости бромида серебра можно записать как:
ПР(AgBr = = [Ag+] . [Br-] = S . S = S2.
Отсюда
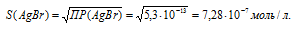
Рассчитаем массу АgВг в 1л раствора, учитывая, что M(Ag+) = 107,688 г/моль, получим:
m(Ag+) = S . M(Ag+) =
= (7,28 . 10-7) . 107,688 = 7,85 . 10-5 г.
Ответ: 7,85 . 10-5 г.
Задача 565.
Вычислить объем воды, необходимый для растворения при 25°С 1 г ВаSO4.
Решение:
ПР(ВаSO4) = 1 . 10-10.
Уравнение диссоциации ВаSO4 имеет вид:
ВаSO4 ⇔ Ba2+ + SO42-.
Обозначим искомую растворимость соли ВаSO4 через S моль/л. Тогда в насыщенном растворе соли содержится по S моль/л ионов Ba2+ и SO42-.
Выражение произведения растворимости сульфата бария можно записать как:
ПР(AgBr) = [Ba2+] . [SO42-] = S . S = S2.
Отсюда
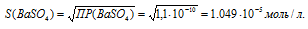
Рассчитаем массу ВаSO4 в 1л раствора, учитывая, что M(ВаSO4) = 233,39 г/моль, получим:
m(ВаSO4) = S . M(ВаSO4) =
= (1,049 . 10-5) . 233,39 = 2,45 . 10-3 г.
Находим объём воды, в котором растворится 1 г ВаSO4 для получения насыщенного раствора его из пропорции:
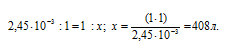
Ответ: 408 л.
Задача 566.
В каком объеме насыщенного раствора Ag2S содержится 1 мг растворенной соли?
Решение:
M(Ag2S) = 247,796 г/моль.
Обозначим искомую растворимость соли Ag2S через S моль/л. Тогда в насыщенном растворе соли содержится 2S моль ионов Ag+ и 1 моль ионов S2-.
Выражение произведения растворимости сульфида серебра можно записать как
ПР(Ag2S) = [Ag+]2 . [S2-] =
= 2S2 . S = 4S3.
Отсюда
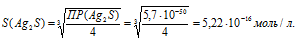
Рассчитаем массу Ag2S в 1л раствора, учитывая, что M(Ag2S) = 247,796 г/моль, получим:
m(Ag2S) = S . M(Ag2S) =
= (5,22 . 10-16) . 247,796 =
= 1,3 . 1013 г или 1,3 . 1010 мг.
Находим объём воды, в котором можно растворить 1 мг сульфида серебра из пропорции:
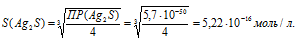
Ответ: 7,69 . 10-11 л.

