Расчеты, связанные с электролизом гидроксида натрия
Задача 1002.
При электролизе водного раствора NаОН на аноде выделилось 2,8 л кислорода (условия нормальные), сколько водорода выделится на катоде: а) 2,8 л; 6) 5,6 л; в) 11,2 л; г) 22,4 л?
Решение:
Электродные процессы:
на катоде: 2Н2О + 2 = Н2↑ + 2ОН−;
= Н2↑ + 2ОН−;
на аноде: 2Н2О - 4 = О2↑ + 4Н+.
= О2↑ + 4Н+.
Суммарное уравнение процесса получим, умножив уравнение на катоде на два и, сложив его с анодным уравнением:
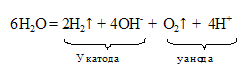
Таким образом, при электролизе водного раствора NaOH на аноде выделяется 1 моль (22,4л) О2, а на катоде – 2 моль (44,8 л) Н2.
Определим объём водорода, выделившийся на катоде, получим:
22,4 : 44,8 = 2,8 : х;
х = (44,8 . 2,8)/22,4 = 5,6 л Н2.
Ответ: б).
Задача 1003.
Каковы продукты взаимодействия йодида калия и хлорида меди (II), если при этом:
Cu2+ + I− + ↔ CuI, φ0 = 0,86 B;
I2 + 2 ↔ 2I−, φ0 = 0,54 B;
↔ 2I−, φ0 = 0,54 B;
Cl2 + 2 ↔ 2Cl−, φ0 = 1,36 B.
↔ 2Cl−, φ0 = 1,36 B.
а) СuI2 и Сl2; б) СuI2 и КСI; в) СuI и Cl2; г) СuI и I2; д) реакция невозможна.
Решение:
Так как стандартный потенциал пары Сu/CuI равен 0,86 B (φ0 = 0,86 B) меньше стандартного потенциала пары Cl2/2Cl−равен 1,36 B (φ0 = 1,36 B), то окислителем будет служить ион йода Cl−, а восстановителем ион Cu2+; поэтому процесс не может самопроизвольно протекать в стандартных условиях.
Так как стандартный потенциал пары I2/2I− равен 0,54 B (φ0= 0,54 B), меньше стандартного потенциала пары Сu/CuI (φ0 = 0,86 B), то окислителем будет служить ион Cu2+, а восстановителем ионы I−; рассматриваемая реакция может протекать.
Действительно данная реакция легко протекает, и при этом образуется осадок CuI. Малорастворимое соединение CuI резко снижает концентрацию ионов Cu2+ (произведение растворимости CuI равно 1,1 . 10-12 ) в растворе:
2CuCl2 + 4KI ↔ 2CuI↓+ I2 + 4KCl.
Ответ: г).

