Задачи по химии на вычисление осмотического давления раствора
Задача 463.
Чему равно осмотическое давление 0,5 М раствора глюкозы С6Н12О6 при 25 °С?
Решение:
Согласно уравнению Р = СМRT, где СМ – молярная концентрация, R – газовая постоянная [8,314 Д ж/(моль . К)], T – температура.
Рассчитаем осмотическое давление:
Р = 0,5 .8,314 . 298 =
= 1238,786 кПа = 1,24 МПа.
Ответ: 1,24 МПа.
Задача 464.
Вычислить осмотическое давление раствора, содержащего 16 г сахарозы С12Н22О11 в 350 г Н2О при 293 К. Плотность раствора считать равной единице.
Решение:
M(С12Н22О11) = 342 г/моль. Для расчётов используем уравнение Р = СМRT, СМ – молярная концентрация, R – газовая постоянная [8,314 Дж/(моль . К)] , T – температура. СМ можно выразить через массу растворённого вещества (m) и его мольную массу (М). Массу сахара, содержащегося в 1000 мл раствора, найдём из пропорции:
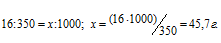
Отсюда
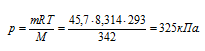
Ответ: 325 кПа.
Задача 465.
Сколько граммов глюкозы С6Н12О6 должно находиться в 0,5 л раствора, чтобы его осмотическое давление (при той же температуре) было таким же, как раствора, в 1 л которого содержится 9,2 г глицерина С3Н5(ОН)3?
Решение:
М(С6Н12О6) = 180г/моль, М[С3Н5(ОН)3] = 92г/моль. Осмотическое давление определяется по формуле: Р = СMRT, где СМ – молярная концентрация, R – газовая постоянная [8,314 Дж/(моль . К)] , T – температура. Из данного уравнения вытекает, что осмотическое давление растворов зависит от концентрации и температуры.
Таким образом, осмотическое давление двух растворов будет одинаковым, если концентрации растворённых веществ будут одинаковыми при одной и той же температуре. Поэтому справедливо равенство:
Р(С6Н12О6) = Р[С3Н5(ОН)3];
СМ(С6Н12О6)RT = СМ[С3Н5(ОН)3]RT
Находим молярную концентрацию глицерина:
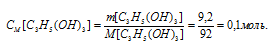
Теперь рассчитаем, сколько граммов глюкозы содержится в 0,5 л 0,1М раствора по формуле:
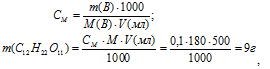
где
СМ, m(B), M(B) и V(мл) соответственно молярная концентрация, масса, молярная масса растворённого вещества и объём раствора.
Ответ: 9 г.
Задача 466.
К 100 мл 0,5 М водного раствора сахарозы добавлено 300 мл воды. Чему равно осмотическое давление полученного раствора при 25 °С?
Решение:
M(С12Н22О11) = 342 г/моль.
Для расчёта массы С12Н22О11 используем формулу:
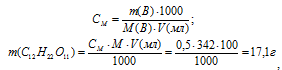
Рассчитаем молярную концентрацию полученного раствора сахарозы, находим:
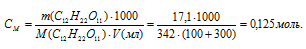
Осмотическое давление полученного раствора находим из формулы: P = CMRT, где
СМ – молярная концентрация, R – газовая постоянная [8,314 Дж/(моль . К)], Т – температура.
Тогда
P = 0,125 . 8,314 . 298 = 309,7 кПа.
Ответ: 309,7 кПа.

