Вычисление потери от растворимости сульфата кальция в граммах и процентах при промывании их указанным объёмом промывной жидкости
Расчет потери от растворимости сульфата бария при промывании его указанным объёмом серной кислоты
Задача 239.
Вычислить потерю от растворимости осадка в граммах и процентах при промывании его указанным объёмом промывной жидкости. Осадок CaSO4, массой 0,70г, Пр(CaSO4) = 9,1 . 10-6; промывная жидкость Н2SO4, объёмом 400 см3, концентрацией 1%.
Решение:
Mr(CaSO4) = 138,144; Mr(Н2SO4) = 98,066.
Рассчитаем массу Н2SO4 в 1 дм3 раствора из пропорции:
100 : 1 = 1000 : х;
х = (1000 . 1)/100 = 10г.
Теперь рассчитаем молярную концентрацию раствора:
CM(Н2SO4) =
=m(Н2SO4)/Mr(Н2SO4) =
= 10/96,066 = 0,1M.
Вычислим растворимость в молях на 1 дм3 CaSO4 в чистой воде, обозначив её через "х", получим:
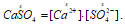
Н2SO4 – сильный электролит, и поэтому:
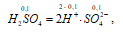
концентрация ионов SO42- равна концентрации кислоты:
[SO42-] = 0,0204 моль/дм3.
Так как ионы Са2+ поступают в раствор только из осадка, то [Са2+] = х, а ионы из осадка SO42- и из промывной жидкости, тогда [SO42-] = х + 0,1. Поскольку х << 0,1 , то можно считать, что вся концентрация ионов SO42-в растворе практически равна его концентрации в промывной жидкости - [SO42-] = 0,1моль/дм3, а значением х, как очень малой величиной, мы можем пренебречь.
Поскольку
Пр(СaSO4) = [Ca2+] . [SO42-] =
= x2 = 9,1 . 10-6 то,
подставив в эту формулу соответствующие значения концентраций ионов, находим:
Пр(СaSO4) = х . 0,1.
Откуда
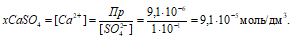
Потери (г) за счёт растворимости равны:
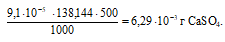
Потери в процентах равны:
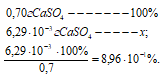
Таким образом, при промывании осадка СaSO4 500 см3 1% раствора H2SO4 мы вносим существенную погрешность в результате потерь от растворимости.
Ответ: 6,29 . 10-3 г; 8,96 . 10-1%.
Вычисление потери от растворимости сульфата кальция при промывании его указанным объёмом воды
Задача 240.
Вычислить потерю от растворимости осадка в граммах и процентах при промывании его указанным объёмом промывной жидкости. Осадок CaSO4, массой 0,60г, Пр(CaSO4) = 9,1 . 10-6; промывная жидкость Н2SO4, объёмом 400 см3, концентрацией 0,02М.
Решение:
Mr(CaSO4) = 138,144.
Вычислим растворимость в молях на 1 дм3 CaSO4 в чистой воде, обозначив её через "х", получим:
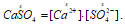
H2SO4 – сильный электролит, и поэтому
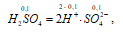
концентрация ионов SO42- равна концентрации кислоты:
[SO42-] = 0,0204моль/дм3.
Так как ионы Са2+ поступают в раствор только из осадка, то [Са2+] = х, а ионы из осадка SO42- и из промывной жидкости, тогда [SO42-] = х + 0,02. Поскольку х << 0,02 , то можно считать, что вся концентрация ионов SO42- в растворе практически равна его концентрации в промывной жидкости - [SO42-] = 0,02моль/дм3, а значением х, как очень малой величиной, мы можем пренебречь.
Поскольку Пр(СaSO4) = [Ca2+] . [SO42-] = x2 = 9,1 . 10-6 то, подставив в эту формулу соответствующие значения концентраций ионов, находим:
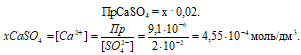
Потери (г) за счёт растворимости равны:
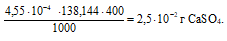
Потери в процентах равны:
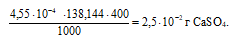
Таким образом, при промывании осадка СaSO4 500 см3 0,02М раствора H2SO4 мы вносим очень существенную погрешность в результате потерь от растворимости.
Ответ: 2,5 . 10-2 г; 4,17%.
Задачи на расчт потери от растворимости соли:
1. Расчт потери от растворимости вольфромата кальция
2. Расчт потери от растворимости карбоната сребра
3. Расчт потери от растворимости хромата свинца

