Расчет количества теплоты химической реакции
Количество теплоты, поглощенное при восстановлении оксида цинка графитом
Задача 1024.
Найти количество теплоты, которое будет поглощено при восстановлении 1 кг оксида цинка графитом. Зависимостью энтальпии реакции от температуры пренебречь.
Решение:
ΔН0(ZNO) = -350,8 кДж/моль;
ΔН0(СО) = -110,6 кДж/моль.
Уравнение реакции:
ZnO + C (графит) = СО + Zn.
Находим тепловой эффект химической реакции, используя следствие из закона Гесса, получим:
ΔН0х.р. = ΔН0(СО) - ΔН0(ZNO) =
= -110,6 – (-350,8) = 240,2 кДж.
Термохимическое уравнение будет иметь вид:
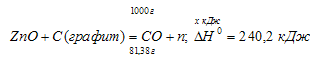
Теперь рассчитаем количество теплоты, которое поглотится при восстановлении 1 кг цинка графитом:
81,38 : 240,2 = 1000 : х;
х = (240,2 . 1000)/81,38 = 2951 кДж.
Ответ: 2951 кДж.
Растворимость латуни в азотной кислоте
Задача 1025.
Кусочек латуни растворили в азотной кислоте. Раствор разделили на две части: к одной части прибавили избыток аммиака, а к другой — избыток щелочи. В растворе или в осадке и в виде каких соединений находятся цинк и медь в обоих случаях?
Решение:
При растворении латуни – сплава меди и цинка в азотной кислоте образуются нитраты цинка и меди. Если на смесь нитратов цинка и меди подействовать раствором щёлочи, то образуется осадок гидроксидов цинка и меди:
Zn(NO3)2 + 2NaOH = Zn(OH)2↓ + 2NaNO3;
Cu(NO3)2 + 2NaOH = Cu(OH)2↓ + 2NaNO3
При добавлении раствора аммиака к смеси нитратов цинка и меди образуются комплексные ионы:
[Zn(NH3)4]2+ и [Сu(NH3)4]2+;
Zn(NO3)2 + 4NH3 = [Zn(NH3)4](NO3)2;
Cu(NO3)2 + 4NН3 = [Cu(NH3)4](NO3)2.
Таким образом, в первом растворе цинк и медь будут находиться в виде гидроксидов, а во тором – в виде комплексных ионов [Zn(NH3)4]2+ и [Сu(NH3)4]2+.

