Составление уравнений для осуществления превращений
Задание 392
Составьте уравнения реакций, которые надо провести для осуществления следующих превращений:
Cu → Cu(NO3)2 → Cu(OH)2 → CuCl2 → [Cu(NH3)4]Cl2
Решение:
а) 3Сu + 8HNO3 (разб.) = 3Сu(NO3)2 + 2NO↑ + 4H2O;
б) Сu(NO3)2 + 2NaOH = Cu(OH)2↓ + 2NaNO3;
в) Cu(OH)2 + 2HCl = CuCl2 + 2H2O;
г) CuCl2 + 4NH3 = [Cu(NH3)4]Cl2
Задание 394
Составьте уравнения реакций, которые надо провести для осуществления следующих превращений:
Ag → AgNO3 → AgCl → [Ag(NH3)2]Cl → AgCl
Решение:
а) Ag + 2HNO3 = AgNO3 + NO2↑ + H2O;
б) AgNO3 + NaCl = AgCl↓ + NaNO3;
в) AgCl + 2NH3 = [Ag(NH)2]Cl;
г) [Ag(NH)2]Cl AgCl↓ + 2NH3↑
Задание 416
Составьте уравнения реакций, которые надо провести для осуществления превращений:
Na2Cr2O7 → Na2CrO4 → Na2Cr2O7 → СгС13 → Сг(ОН)3. Уравнение окислительно-восстановительной реакции напишите на основании электронных уравнений.
Решение:
Уравнения реакций, которые надо провести для осуществления превращений:
Na2Cr2O7 → Na2CrO4 → Na2Cr2O7 → СгС13 → Сг(ОН.
а) Na2Cr2O7 + 2NaOH = Na2CrO4 + H2O.
б) Na2CrO4 + H2SO4 = Na2Cr2O7 + Na2SO4 + H2O.
Под действием щёлочи дихромат-ионы Cr2O72- переходят в хромат-ионы CrO4. При подкислении растворов хроматов ионы CrO42- переходят в Cr2O72-.
в) Кислые растворы хроматов и дихроматов обладают окислительными свойствами. При их восстановлении жёлтая окраска хроматов или оранжевая дихроматов переходят в зеленную окраску, обусловленную присутствием ионов Cr3+.
Уравнения электронного баланса:
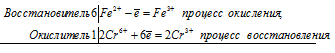
6Fe2+ + 2Cr6+ = 6Fe3+ + 2Cr3+
Молекулярное уравнение реакции:
Na2Cr2O7 + 14HCl + 6FeCl2 = 2CrCl3 + 6FeCl3 + 2NaCl + 7H2O;
г) При действии на соль CrCl3 раствором щёлочи выпадает осадок Сг(ОН)3:
CrCl3 + 3KOH = Сг(ОН)3↓ + 3KCl
Задание 427
Составьте уравнения реакций, которые надо провести для осуществления превращений:
Ni → Ni(NO3)2 → Ni(OH)2 → Ni(ОН)3 → NiCl2. Уравнения окислительно-восстановительных реакций напишите на основании электронных уравнений.
Решение:
Уравнения реакций, которые надо провести для осуществления превращений:
Ni → N i(NO3)2 → Ni(OH)2 → Ni(ОН)3 → NiCl2.
а) Ni → N i(NO3)2 =
Уравнения электронного баланса:
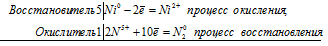
5Ni0 + 2N5+ = 5Ni2+ + N20
Молекулярное уравнение реакции:
5Ni + 12HNO3 = 5Ni(NO3)2 + N2 + 6H2O;
б) Ni(NO3)2 → Ni(OH)2 =
Ni(NO3)2 + 2NaOH = Ni(OH)2↓ + 2NaNO3;
в) Ni(OH)2 → Ni(ОН)3 =
Уравнения электронного баланса:
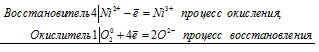
4Ni2+ + O20 = 4Ni3+ + 2O2-
Молекулярное уравнение реакции:
4Ni(OH)2 + O2 + 2H2O = 4Ni(ОН)3↓;
г) Ni(ОН)3 → NiCl2 =
Уравнения электронного баланса:
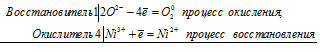
4Ni3+ + 2O2- = 4Ni2+ + O20.
Молекулярное уравнение реакции:
4Ni(OH)3 + 8HCl = 4NiCl2 + O2↑ + 10H2O.

