Определение молярных масс фосфора при разных температурах
Задача 913.
При 800 °С плотность паров фосфора по отношению к воздуху составляет 4,27, а при 1500 °С она уменьшается в два раза. Из скольких атомов состоит молекула фосфора при указанных температурах?
Решение:
Молярная масса воздуха равна 29 г/моль. По формуле:
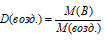
Рассчитаем молярные массы фосфора при разных температурах, получим:
а) находим молярную массу фосфора при 800 0С:
М(Р') = D(возд.) . М(возд.) = 4,27 . 29 = 123,83 г/моль;
б) находим молярную массу фосфора при 1500 °С:
М(P") = D(возд.) . М(возд.) =
= (4,27/2) . 29 = 61,915 г/моль.
Рассчитаем, из скольких атомов состоит молекула фосфора при разных температурах:
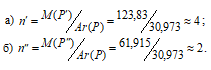
Здесь D(возд.) - плотность вещества по воздуху; М(В) – молярная масса вещества; n – число атомов в молекуле вещества (В).
Таким образом, при температуре 800 оС молекула газообразного фосфора состоит из 4 атомов (Р4), а при 1500 0С – из 2 (Р2).
Ответ: а) из 4-х атомов; б) из из 2-х атомов.
Задача 914.
Какое количество теплоты выделяется при превращении 1 т белого фосфора в красный, если теплота перехода составляет 16,73 кДж на 1 моль атомов?
Решение:
Уравнение реакции имеет вид:
Р(белый) ⇒ Р(красный) ; ΔН = -16,73 кДж.
Находим количество фосфора:
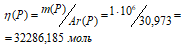
Рассчитаем количество теплоты, которое выделилось при переходе 1 т. белого фосфора в красный, получим:
ΔН0х.р = [(1000000/31)] . 16,73 =
= 540147,87 = 5,4 . 105 кДж.
Ответ: ΔН0х.р = 5,4 . 105 кДж.
Задача 915.
Указать названия и формулы аммонийных солей ортофосфорной кислоты. Почему аммиак может быть получен из них непосредственным нагреванием, тогда как для получения аммиака из хлорида аммония последний необходимо предварительно смешать с гашеной известью или щелочью?
Решение:
Формулы аммонийных солей ортофосфорной кислоты:
(NH4)H2PO4 — дигидроортофосфат аммония (аммония дигидроортофосфат);
(NH4)2HPO4 — гидроортофосфат аммония (диаммония гидроортофосфат);
(NH4)3PO4 — ортофосфат аммония (триаммония ортофосфат).
Аммонийные соли нелетучей ортофосфорной кислоты разлагаются до конца с образованием аммиака и кислоты:
(NH4)H2PO4  NH3↑ + H3PO4;
NH3↑ + H3PO4;
(NH4)2HPO4  2NH3↑ + H3PO4;
2NH3↑ + H3PO4;
(NH4)3PO4  3NH3↑ + H3PO4.
3NH3↑ + H3PO4.
Так, при нагревании хлорида аммония происходит его термическая
NH4Cl  NH3↑ + HCl↑,
NH3↑ + HCl↑,
а образующиеся продукты, покинув зону высокой температуры, вновь реагируют друг с другом. Таким образом, хлорид аммония (или нашатырь), - возгоняется (испаряется при нагревании), поэтому для в лаборатории аммиак обычно получают, нагревая хлорид аммония с гашеной известью. Реакция выражается уравнением:
2NH4Cl + Ca(OH)2 =
= CaCl2 + 2NH3↑ + H2O↑.
Выделяющийся аммиак содержит пары воды. Для осушения его пропускают через натронную известь (смесь извести с едким натром).

