Окисление и восстановление ионов водными растворами кислот, солей
Задача 680.
Водный раствор Н2S обладает восстановительными свойствами. Какие из перечисленных ионов можно восстановить этим раствором: а) Ее3+ до Fe2+; б) Cu2+ до Сu+; в) Sn4+ до Sn2+?
Решение:
Запишем уравнения электронного баланса электрохимических систем участвующих в реакциях:
а) Ее3+ до Fe2+
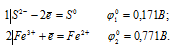
Поскольку  10 <
10 <  20, то окислителем будут служить ион железа Fe3+, а восстановителем ион серы S2-; рассматриваемая реакция будет протекать слева направо, поэтому процесс может самопроизвольно протекать в стандартных условиях.
20, то окислителем будут служить ион железа Fe3+, а восстановителем ион серы S2-; рассматриваемая реакция будет протекать слева направо, поэтому процесс может самопроизвольно протекать в стандартных условиях.
б) Cu2+ до Сu+
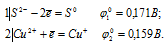
Поскольку  10 >
10 >  20, то окислителем будет служить ион S2-, а восстановителем ион Cu2+; рассматриваемая реакция будет протекать справа налево, поэтому процесс не может самопроизвольно протекать в стандартных условиях.
20, то окислителем будет служить ион S2-, а восстановителем ион Cu2+; рассматриваемая реакция будет протекать справа налево, поэтому процесс не может самопроизвольно протекать в стандартных условиях.
в) Sn4+ до Sn2+
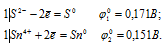
Поскольку  10 >
10 >  20, то окислителем будет служить ион S2-, а восстановителем ион Sn4+; рассматриваемая реакция будет протекать справа налево, поэтому процесс не может самопроизвольно протекать в стандартных условиях.
20, то окислителем будет служить ион S2-, а восстановителем ион Sn4+; рассматриваемая реакция будет протекать справа налево, поэтому процесс не может самопроизвольно протекать в стандартных условиях.
Ответ: а).
Задача 681.
Бромная вода (раствор брома в воде) - часто используемый в лабораторной практике окислитель. Какие из перечисленных ионов можно окислить бромной водой:
а) Fe2+ до Ее3+; б) Cu+ до Cu2+; в) Мп2+ до MnO4-; г) Sn2+ до Sn4+?
Решение:
Запишем уравнения электронного баланса электрохимических систем участвующих в реакциях:
а) Fe2+ до Ее3+
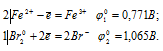
Поскольку  10 >
10 >  20, то окислителем будут служить бром, а восстановителем ион железа Fe2+; рассматриваемая реакция будет протекать слева направо, поэтому процесс может самопроизвольно протекать в стандартных условиях.
20, то окислителем будут служить бром, а восстановителем ион железа Fe2+; рассматриваемая реакция будет протекать слева направо, поэтому процесс может самопроизвольно протекать в стандартных условиях.
б) Cu+ до Cu2+
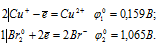
Поскольку  10 <
10 <  20, то окислителем будут служить бром, а восстановителем ион Cu+; рассматриваемая реакция будет протекать слева направо, поэтому процесс может самопроизвольно протекать в стандартных условиях.
20, то окислителем будут служить бром, а восстановителем ион Cu+; рассматриваемая реакция будет протекать слева направо, поэтому процесс может самопроизвольно протекать в стандартных условиях.
в) Мп2+ до MnO4-
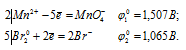
Поскольку  10 >
10 >  20, то окислителем будет служить ион марганца Mn2+, а восстановителем бром; рассматриваемая реакция будет протекать справа налево, поэтому процесс не может самопроизвольно протекать в стандартных условиях.
20, то окислителем будет служить ион марганца Mn2+, а восстановителем бром; рассматриваемая реакция будет протекать справа налево, поэтому процесс не может самопроизвольно протекать в стандартных условиях.
г) Sn2+ до Sn4+
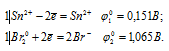
Поскольку  10 <
10 <  20, то окислителем будут служить бром, а восстановителем ион Sn2+; рассматриваемая реакция будет протекать слева направо, поэтому процесс может самопроизвольно протекать в стандартных условиях.
20, то окислителем будут служить бром, а восстановителем ион Sn2+; рассматриваемая реакция будет протекать слева направо, поэтому процесс может самопроизвольно протекать в стандартных условиях.
Ответ: а); б); г).
Задача 682.
На раствор сульфата меди (II) действуют хлоридом калия или иодидом калия. В каких случаях медь (II) будет восстанавливаться до меди (I): а) в обоих случаях; б) при взаимодействии КСI; в) при взаимодействии с КI; г) ни в одном из случаев?
Решение:
Запишем уравнения электронного баланса электрохимических систем участвующих в реакциях:
а) На раствор сульфата меди (II) действуют хлоридом калия:
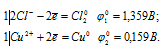
Поскольку  10 >
10 >  20, то окислителем будет служить ион хлора Cl-, а восстановителем ион Cu2+; рассматриваемая реакция будет протекать справа налево, поэтому процесс не может самопроизвольно протекать в стандартных условиях.
20, то окислителем будет служить ион хлора Cl-, а восстановителем ион Cu2+; рассматриваемая реакция будет протекать справа налево, поэтому процесс не может самопроизвольно протекать в стандартных условиях.
б) На раствор сульфата меди (II) действуют иодидом калия
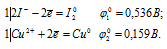
Поскольку  10 <
10 <  20, то окислителем будет служить ион йода I-, а восстановителем ион Cu2+; рассматриваемая реакция будет протекать справа налево, поэтому процесс не может самопроизвольно протекать в стандартных условиях. Однако данная реакция легко протекает, и при этом образуется осадок CuI. Малорастворимое соединение CuI резко снижает концентрацию ионов Cu2+ (произведение растворимости CuI равно 1,1 . 10-12 ) в растворе. Подставляя значение произведения растворимости в уравнение Нернста, рассчитаем стандартный потенциал новой пары Сu/CuI, получим:
20, то окислителем будет служить ион йода I-, а восстановителем ион Cu2+; рассматриваемая реакция будет протекать справа налево, поэтому процесс не может самопроизвольно протекать в стандартных условиях. Однако данная реакция легко протекает, и при этом образуется осадок CuI. Малорастворимое соединение CuI резко снижает концентрацию ионов Cu2+ (произведение растворимости CuI равно 1,1 . 10-12 ) в растворе. Подставляя значение произведения растворимости в уравнение Нернста, рассчитаем стандартный потенциал новой пары Сu/CuI, получим:
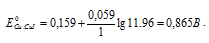
Теперь  10 <
10 <  20, то окислителем будет служить ион Cu2+, а восстановителем ионы I-; рассматриваемая реакция может протекать.
20, то окислителем будет служить ион Cu2+, а восстановителем ионы I-; рассматриваемая реакция может протекать.
Ответ: в).

