Определение молекулярной формулы спирта
Наиболее распространены в тестах ЕГЭ задачи, в которых расчет ведется по уравнению реакции. Рассмотрим наиболее сложную из них.
Задача 2.6.
При взаимодействии 1,48 г предельного одноатомного спирта с металлическим натрием выделился водород в количестве, достаточном для гидрирования 224 мл этилена (н.у.). Определите молекулярную формулу спирта.
Дано:
масса предельного одноатомного спирта: m(спирта) = 1,48 г;
объем этилена (н.у.): V(С2Н4) = 224 мл.
Найти: формулу исходного спирта.
Решение:
Шаг 1. В состав предельного одноатомного спирта входят углерод, водород и один атом кислорода. Общая формула имеет вид: СnH2n+1ОН.
Шаг 2. В условии описаны две последовательные химические реакции:
2СnH2n+1ОН + 2Na → 2СnH2n+1ОNa + H2
Водород, выделившийся в первой реакции, участвует, во взаимодействии с этиленом:
Н2С = СН2 + Н2 → Н3С – СН3
Шаг 3 и 4. Соотношение атомов и простейшая формула спирта однозначно определяется по общей формуле, но эти данные не помогут нам при выявлении истинной формулы.
Шаг 5. Для выявления значения «n» в общей формуле спирта необходимо сопоставить массу спирта с количеством образовавшегося водорода по первому уравнению реакции. Количество образовавшегося водорода можно определить по второй реакции гидрирования.
а) Определение количества вещества водорода1:
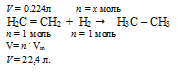
Составляем пропорцию:
0,224 л Н2С = СН2 взаимодействуют с х моль Н2 (по условию)
22,4 л Н2С = СН2 взаимодействуют с 1 моль Н2 (по уравнению)
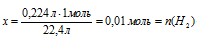
– количество вещества водорода, который расходовался в реакции гидрирования этилена.
б) Водород, принявший участие в реакции с этиленом, выделился в первой реакции спирта с металлическим натрием. Следовательно, можно использовать полученные данные для сопоставления с массой исходного спирта.
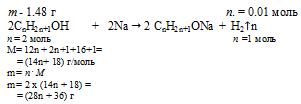
Составляем пропорцию:
1,48 г СnH2n+1ОН дает 0,01 моль Н2 (по условию);
(28n + 36) г СnH2n+1ОН дает 1 моль Н2 (по уравнению);
1,48 . 1 = (28n + 36) . 0,01.
Получили математическое уравнение с одним неизвестным. Решая его, получаем:
n = 4.
Подставляем это значение в общую формулу спирта:
С4Н9ОН.
Ответ: С4Н9ОН.
Данная задача была осложнена двумя последовательными уравнениями реакций. Для сопоставления данных с целью определения неизвестного индекса в общей формуле нам пришлось проводить дополнительный расчет по второму химическому уравнению. В большинстве задач ЕГЭ в условии описана лишь одна реакция и присутствуют данные о двух веществах в ней. После записи уравнения с использованием общей формулы можно сразу приступать к сопоставлению данных и выявлению неизвестных индексов.
Задачи на установление молекулярной формулы вещства:
1. Определение молекулярной формулы алкена
2. Определение молекулярной формулы эфира
3. Определение молекулярной формулы формальдегида
Комментарии:
1 Объем газообразного этилена в условии выражен в миллилитрах. Для использования этого данного в пропорции необходимо перевести его в литры, т.к. молярный объем измеряется в л/моль. Ошибку, связанную с приведением данных к одним единицам измерения делают многие учащиеся.
Источник:
ЕГЭ. Химия. Расчетные задачи в тестах ЕГЭ. Части А, В, С / Д.Н. Турчен. — М.: Издательство «Экзамен», 2009. — 399 [1]с. (Серия «ЕГЭ. 100 баллов»). I8ВN 978-5-377-02482-8.

