"Химия. 10 класс". О.С. Габриелян (гдз)
Характеристика спиртов
Опыт 1. Растворимость спиртов в воде.
Условия выполнения работы:
В две пробирки налили примерно по 2 мл этилового и изоамилового спиртов. Добавили в каждую из пробирок по 3 мл воды и взболтали. Наблюдаем, что этиловый спирт растворился, а изоамиловый нет, и при стоянии образует верхний маслянистый слой, так как его плотность меньше плотности воды (0,8 г/мл). Причиной различного поведения спиртов в воде является природа веществ.
Опыт 2. Получение глицерата меди.
Условия выполнения работы:
В пробирку налили 1 мл 10%-го раствора сульфата меди (II) и добавили немного 10%-го раствора гидроксида натрия. Наблюдаем выпадение голубого осадка Cu(OH)2. К полученному осадку добавили по каплям глицерин, смесь взболтали. Наблюдаем растворение осадка и окрашивание раствора в ярко-синий цвет, происходит реакция.
Уравнения реакции взаимодействия сульфата меди (ΙΙ) с гидроксидом натрия:
CuSO4 + 2NaOH ↔ Cu(OH)2↓ + Na2SO4
Качественной реакцией на многоатомные спирты является реакция с гидроксидом меди (ΙΙ). Например, при действии глицерина на осадок гидроксида меди (ΙΙ) наблюдается растворение осадка и окрашивание раствора в ярко-синий цвет, происходит реакция.
Уравнение реакции имеет вид:
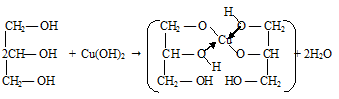
Этиловый и изоамиловый спирты не будут реагировать с Cu(OH)2, так как это качественная реакция на многоатомные спирты.
Опыт 3. Окисление этилового спирта хромовой смесью.
Условия выполнения работы:
Налили в пробирку 2 мл 5%-го раствора дихромата калия, 1 мл 20%-го раствора серной кислоты и 0,5 мл этилового спирта, получили смесь оранжевого цвета. Пробирку нагрели. Наблюдаем изменение цвета раствора на зелёный и чувствуем характерный запах уксусного альдегида.
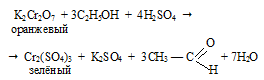
В данной реакции применяют серную кислоту, а не соляную, потому что соляная кислота может окислиться.

