Вычисление процентного содержания алюминия, сульфата алюминия и сульфата железа (ⅠⅠ) в аналитическом образце вещества
Расчет процентного содержания алюминия в образце сульфата алюминия
Задача 174.
Вычислите процентное содержание определяемого вещества в аналитическом образце по следующим данным: исследуемое вещество сульфат алюминия, навеска массой 1,2000 г; определяемое вещество Al; весовая форма Al2O3, массой равной 0,1218 г.
Решение:
Расчёт процентного содержания определяемого вещества в пробе проводим по формуле:
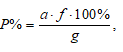
где
а - масса весовой формы определяемого вещества, г;
f - аналитический множитель (фактор пересчета);
g - масса навески, г;
Р - приблизительное процентное содержание вещества в образце.
Ar(Al) = 26,98;
Mr(Al2O3) = 101,96;
f = 2Ar(Al)/Mr(Al2O3) =
= (2 . 26,98)/101,96 = 0,5292.
Подставив все числовые значения в расчётную формулу, получим:
Р% = (0,1218 . 0,5292 . 100%)/1,1200 = 5,37%.
Ответ: Р% = 5,37%.
Вычисление процентного содержания сульфата аммония в образце сульфата аммония
Задача 175.
Вычислите процентное содержание определяемого вещества в аналитическом образце по следующим данным: исследуемое вещество сульфат алюминия, навеска массой 1,4000 г; определяемое вещество Al2(SO4)3; весовая форма Al2O3, массой равной 0,0522 г.
Решение:
Расчёт процентного содержания определяемого вещества в пробе проводим по формуле:
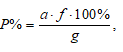
где
а - масса весовой формы определяемого вещества, г;
f - аналитический множитель (фактор пересчета);
g - масса навески, г;
Р - приблизительное процентное содержание вещества в образце.
Mr[Al2(SO4)3] = 342,158;
Mr(Al2O3) = 101,96;
f = Mr[Al2(SO4)3]/Mr(Al2O3) =
= 342,158/101,96 = 3,3558.
Подставив все числовые значения в расчётную формулу, получим:
Р% = (0,0522 . 3,3558 . 100%)/1,4000 = 12,51%.
Ответ: Р% = 12,51%.
Вычисление процентного содержания FeSO4 в образце сульфата железа (ⅠⅠ)
Задача 176.
Вычислите процентное содержание определяемого вещества в аналитическом образце по следующим данным: исследуемое вещество сульфат железа, навеска массой 0,9800 г; определяемое вещество FeSO4; весовая форма Fe2O3, массой равной 0,3775 г.
Решение:
Расчёт процентного содержания определяемого вещества в пробе проводим по формуле:
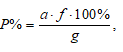
где
а - масса весовой формы определяемого вещества, г;
f - аналитический множитель (фактор пересчета);
g - масса навески, г;
Р - приблизительное процентное содержание вещества в образце.
Mr(FeSO4) = 151,911;
Mr(Fe2O3) = 159,69;
f = 2Mr(FeSO4)/Mr(Fe2O3) =
= (2 . 151,911)/159,69 = 1,9025.
Подставив все числовые значения в расчётную формулу, получим:
Р% = (03775 . 1,9025 . 100%)/0,9800 = 9,45%.
Ответ: Р% = 9,45%.

