"Химия. 11 класс". О.С. Габриелян (гдз)
Решение экспериментальных задач по теме «Гидролиз»
Задача I.
В пробирку налили немного раствора AlCl3 и прилили к нему несколько капель раствора сульфида натрия. Наблюдаем выпадение осадка и выделение газа с неприятным запахом тухлых яиц — это Н2S. Это пример взаимного усиления гидролиза:
2AlCl3 + 3NaS + 6H2O ↔ 2Al(OH)3 + 6NaCl + 3H2S
Задача II.
Две стеклянные трубки, в которых находится свернутый белок, погрузили в растворы, нагретые до t = 36,6 °C (нормальная температура тела человека), одну в раствор желудочного сока, другую в 3,5%-й раствор НСI. Спустя некоторое время наблюдаем в первой пробирке растворение белка, который под действием ферментов гидролизовался до аминокислот:
белок 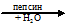 аминокислота
аминокислота
Задача III.
Налили в пробирку раствор FеСI3 и присыпали немного порошка цинка. Наблюдаем выделение пузырьков газа. Это объясняется тем, что в растворе произошел частичный гидролиз FеСI3, образовалось некоторое количество НСI, которая реагирует с цинком, при этом наблюдается выделение водорода.
FеСI3 + H2O ↔ Fe(OH)Cl2 + HCl;
2HCl + Zn ↔ ZnCl2 + H2.
Задача IV.
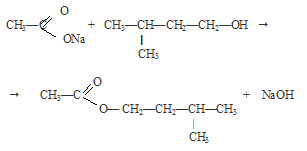
В колбу поместили немного изоамилацетата — сложного эфира. Затем добавили несколько капель индикатора фенолфталеина и по каплям концентрированный раствор NаОН до не исчезающего при перемешивании окрашивания в малиновый цвет. Закрыли пробирку пробкой с прямой трубкой и нагрели ее до слабого кипения. Наблюдаем исчезновение окраски раствора.
Вновь добавили несколько капель щелочи, окраска снова появилась. Затем пробирку опять нагрели до исчезновения окраски. Смесь охладили и добавили к раствору несколько капель раствора FеСI3. Наблюдаем выпадение бурого осадка.
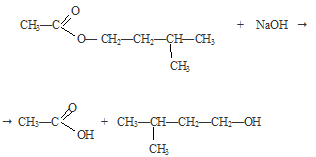
Щелочь делает процесс гидролиза сложного эфира необратимым при обычных условиях. При нагревании происходит обратная реакция этерификации.
FeCl3 + 3NaOH ↔ Fe(OH)3↓ + 3NaCl.
Так как в растворе все равно присутствует NaOH, он реагирует с FeCl3, образуется осадок Fe(OH)3.

