Составление уравнений окислительно-восстановительных реакций
Решение задач на определение коэффициентов в уравнениях химических реакций
Задание 221.
Исходя из степени окисления хлора в соединениях НСI, НСIО3, НСlO4, определите, какое из них является только окислителем, только восстановителем и какое может проявлять как окислительные, так и восстановительные свойства. Почему? На основании электронных уравнений расставьте коэффициенты в уравнении реакции, идущей по схеме: КВг + КВгО3 + Н2SO4 → Вг2 + К2SO4 + Н2O.
Решение:
Степень окисления хлора в указанных соединениях соответственно равна -1 (низшая), +5 (промежуточная), +7 (высшая). Отсюда следует, что HCl только восстановитель, HClO – окислитель и восстановитель, HClO4 – только окислитель. HCl – только восстановитель, потому что атом хлора в своей низшей степени окисления не может её понизить (принять электроны) и проявляет только восстановительные свойства. HClO может проявлять как восстановительные, так и окислительные свойства, потому что в своей промежуточной степени окисления может присоединять пять электронов и отдавать два электрона. HClO4 может быть только окислителем, потому что в своей высшей степени окисления не может её повысить (отдать электроны).
Коэффициенты определяют методом электронного баланса с помощью электронных уравнений. Вычисляем, как изменяют степень окисления восстановитель с окислителем и отражаем это в электронных уравнениях:
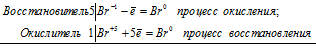
5Br-1 + Br+5 = 6Br0
Общее число электронов, отданных восстановителем должно быть равно числу электронов, которые присоединяет окислитель. Наименьшее кратное для принятых и отданных электронов в данном процессе равно 5. Тогда, разделив число 5 на 5, получим коэффициент 1 для восстановителя и продукта его окисления, а разделив 5 на 1 получаем коэффициент для окислителя и продуктов его восстановления. Коэффициент перед веществами, атомы которых не участвуют в процессе окисления-восстановления, т. е. не меняют свою степень окисления, находим методом подбора. Уравнение реакции будет иметь вид:
5КВг + КВгО3 + 3Н2SO4 → 3Вг2 + 3К2SO4 + 3Н2O
Задание 222.
Реакции выражаются схемами:
Р + НIО3 + Н2О → Н3РО4 + НI;
Н2S + Сl2 +Н2O → Н2SO4 + НСl
Составьте электронные уравнения. Расставьте коэффициенты в уравнениях реакций. Для каждой реакции укажите, какое вещество является окислителем, какое - восстановителем; какое вещество окисляется, какое - восстанавливается.
Решение:
Коэффициенты определяют методом электронного баланса с помощью электронных уравнений. Вычисляем, как изменяют степень окисления восстановитель и окислитель, отражаем это в электронных уравнениях. Далее учитываем: общее число электронов отданных восстановителем должно быть равно числу электронов, которые присоединяет окислитель. Коэффициенты для восстановителя и окислителя идентичны как для продуктов восстановления, так и для продуктов окисления реакции. Коэффициенты для веществ, атомы которых не меняют свою степень окисления, находят методом подбора.
а) Р + НIО3 + Н2О → Н3РО4 + НI
уравнения электронного баланса:
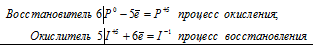
6P0 + 5I+5 = 6P+5 + I-1
Молекулярное уравнение:
6Р + 5НIО3 + 9Н2О → 6Н3РО4 + 5НI
В данной реакции: НIО3 – окислитель, который восстанавливается до НI, при этом степень окисления йода уменьшается от +5 до -1; Р – восстановитель, который окисляется до Н3РО4, при этом степень окисления фосфора увеличивается от 0 до +5.
б) Н2S + Сl2 +Н2O → Н2SO4 + НС1
уравнения электронного баланса
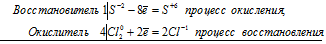
S-2 + 4Cl20 = S+6 + 8Cl-1
Молекулярное уравнение:
Н2S +4Сl2 +4Н2O → Н2SO4 + 8НСl
В данной реакции: Cl2 – окислитель, который восстанавливается до НCl, при этом степень окисления хлора уменьшается от 0 до -1; Н2S – восстановитель, который окисляется до Н2SO4, при этом степень окисления серы увеличивается от -2 до +6.
Задание 223.
Составьте электронные уравнения и укажите, какой процесс - окисление или восстановление - происходит при следующих превращениях: As3- → As5+; N3+→ N3-; S2- → S0.
На основании электронных уравнений расставьте коэффициенты в уравнении реакции, идущей по схеме: Na2SO3 + КМnO4 + Н2O → Na2SO4 + МnO2 + КОН.
Решение:
а) Электронное уравнение:
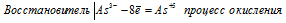
При превращении As3- → As5+ происходит процесс окисления (отдача электронов).
б) Электронное уравнение:
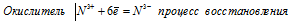
При превращении N3+ → N3- происходит процесс восстановления (присоединение электронов).
в) Электронное уравнение:
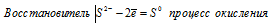
При превращении S2- → S0 происходит процесс окисления (отдача электронов).
Na2SO3 + КМnO4 + Н2O →
→ Na2SO4 + МnO2 + КОН
Если в условии задачи даны как исходные вещества, так и продукты их взаимодействия, то написание уравнения реакции сводится, как правило, к нахождению и расстановке коэффициентов. Коэффициенты определяют методом электронного баланса с помощью электронных уравнений. Вычисляем, как изменяют степень окисления восстановитель и окислитель, и отражаем это в электронных уравнениях:
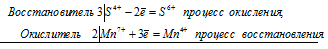
3S4+ + 2Mn7+ = 3S6+ + 2Mn4+
Общее число электронов, отданных восстановителем, должно быть равно числу электронов, которые присоединяет окислитель. Общее наименьшее кратное для отданных и принятых электронов шесть. Разделив это число на 3, получаем коэффициент 2 для окислителя и продукта его восстановления, а при делении 6 на 2 получаем коэффициент 3 для восстановителя и продукта его окисления. Коэффициент перед веществами, атомы которых не меняют свою степень окисления, находят подбором. Молекулярное уравнение реакции:
3Na2SO3 + 2КМnO4 + Н2O →
→ 3Na2SO4 + 2МnO2 + 2КОН
Задание 224.
Исходя из степени окисления фосфора в соединениях РН3, Н3РО4, Н3РО3, определите, какое из них является только окислителем, только восстановителем и какое может проявлять как окислительные, так и восстановительные свойства. Почему? На основании электронных уравнений расставьте коэффициенты в уравнении реакции, идущей по схеме:
РbS + HNO3 → S + Рb(NO3)2+ NО + Н2O
Решение:
а) Степень окисления фосфора в указанных соединениях соответственно равна: -3 (низшая), +5 (высшая), +3 (промежуточная). Отсюда: РН3 — только восстановитель; Н3РО4 -только окислитель; Н3РО3 - окислитель и восстановитель.
б) Уравнения ионно-электронного баланса:
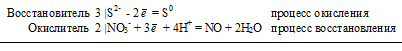
3S2- + 2NO3- + 8H+ = 3S0 + 2NO + 4H2O.
Молекулярное уравнение реакции:
3РbS + 8HNO3 →
→ 3S + 3Рb(NO3)2 + 2NО + 4Н2O.
В данной реакции: РbS – восстановитель, HNO3 – окислитель; РbS окисляется до S, HNO3 – восстанавливается до NO.
Задание 225.
Реакции выражаются схемами:
Р + НNО3 + Н2О → Н3РО4 + NO;
KMnO4 + Na2SO3 + KOH → K2MnO4 + Na2SO3 + Н2O.
Составьте электронные уравнения. Расставьте коэффициенты в уравнениях реакций. Для каждой реакции укажите, какое вещество является окислителем, какое - восстановителем; какое вещество окисляется, какое - восстанавливается.
Решение:
Если в условии задачи даны как исходные вещества, так и продукты их взаимодействия, то написание уравнения реакции сводится, как правило, к нахождению и расстановке коэффициентов. Коэффициенты определяют методом электронного баланса с помощью электронных уравнений. Вычисляем, как изменяют степень окисления восстановитель и окислитель, и отражаем это в электронных уравнениях. Коэффициенты для восстановителя и окислителя идентичны для продуктов окисления и восстановления. . Коэффициент перед веществами, атомы которых не меняют свою степень окисления, находят подбором.
а) Р + НNО3 + Н2О → Н3РО4 + NO
Уравнения электронного баланса:
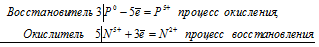
3Р0 + 5N5+ = 3P5+ + 5N2+
Общее число электронов, отданных восстановителем, должно быть равно числу электронов, которые присоединяет окислитель. Общее наименьшее кратное для отданных и принятых электронов пятнадцать. Разделив это число на 3, получаем коэффициент 5 для окислителя и продукта его восстановления, а при делении 15 на 5 получаем коэффициент 3 для восстановителя и продукта его окисления. Молекулярное уравнение реакции:
3Р + 5НNО3 + 2Н2О → 3Н3РО4 + 5NO
В данной реакции: Р – восстановитель, НNО3 – окислитель; Р окисляется до Н3РО4,НNО3 – восстанавливается до NO.
б)KMnO4 + Na2SO3 + KOH = K2MnO4 +Na2SO4 + Н2O
Уравнения электронного баланса:
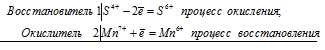
S0 + 2Mn7+ = S6+ + 2Mn6+
Общее число электронов, отданных восстановителем, должно быть равно числу электронов, которые присоединяет окислитель. Общее наименьшее кратное для отданных и принятых электронов два. Разделив это число на 1, получаем коэффициент 2 для окислителя и продукта его восстановления, а при делении 2 на 2 получаем коэффициент 1 для восстановителя и продукта его окисления. Молекулярное уравнение реакции:
2KMnO4 + Na2SO3 +2KOH →
→ 2K2MnO4 + Na2SO4 + Н2O.
В данной реакции: Na2SO3 – восстановитель, KMnO4 – окислитель; Na2SO3 окисляется до Na2SO4, KMnO4 – восстанавливается до K2MnO4.

