Получение тиостаната натрия
Задача 1074.
Как, исходя из металлического олова, получить тиостаннат натрия?
Решение:
При действии хлора на металлическое олово образуется хлорид олова (IV) SnCl4:
Sn + 2Cl2 = SnCl4.
Далее при действии сероводорода на хлорид олова (IV) получается осадок жёлтого цвета дисульфида олова:
SnCl4 + 2H2S = SnS2↓ + 4HCl.
Дисульфид олова можно получить нагреванием оловянных опилок с серой и хлоридом аммония (Sn + 2S.= SnS2). Приготовленный по этому способу дисульфид олова имеет вид золотисто-жёлтых чешуек и под названием «сусального золота» употребляется для позолоты дерева. Применение хлорида аммония основано на том, что он способствует удалению с поверхности олова оксидной пленки, благодаря чему олово активируется и реакция его с серой проходит лучше. Удаление оксидной плёнки проходит по схеме:
Sn3O4 + 8NH4Cl =
= SnCl2 + SnCl3 + 8NH3↑ + 4H2O.
Дисульфид олова можно растворить в сульфиде натрия, причём получается растворимая соль тиостанат натрия:
SnS2 + Na2S = Na2SnS3.
Устойчивость различных состояний окисленности олова и свинца
Задача 1075.
Пользуясь табличными данными приложения, на основании рассмотрения процесса:
2МО + О2 = 2МО2 сделать вывод о сравнительной устойчивости различных состояний окисленности олова и свинца.
Решение:
(PbO) = -186, 2 кДж/моль;
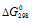 (PbO2) = -218,45 кДж/моль;
(PbO2) = -218,45 кДж/моль;
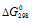 (SnO) = -258,1 кДж/моль;
(SnO) = -258,1 кДж/моль;
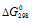 (SnO2) = -520,2 кДж/моль.
(SnO2) = -520,2 кДж/моль.
а) Уравнение реакции:
2PbO + O2 = 2PbO2
Находим энергию Гиббса реакции:
 (а) = 2(PbO2) - 2(PbO) =
(а) = 2(PbO2) - 2(PbO) =
= 2(-218,45) – 2(-186,2) = -64,5 кДж.
б) Уравнение реакции:
2SnO + O2 = 2SnO2
Находим энергию Гиббса реакции:
 (б) = 2(SnO2) - 2(SnO) =
(б) = 2(SnO2) - 2(SnO) =
= 2(-520,2) – 2(-258,1) = -24,2 кДж.
Выводы:
1) Так как  (а) <
(а) <  (б), то состояние окисленности свинца более устойчивое, чем состояние окисленности олова.
(б), то состояние окисленности свинца более устойчивое, чем состояние окисленности олова.

