Количественное осаждение соли сульфата аммония и кристаллогидрата нитрата кальция
Осаждение соли сульфата аммония
Задача 135.
Написать уравнения реакции осаждения, рассчитать объём осадителя, необходимый для проведения количественного осаждения, и описать условия осаждения. Исследуемое вещество (NH4)2SO4, навеска массой 0,40 г; осадитель BaCl2 . 2H2O, концентрация 2 М.
Решение:
Схема реакции осаждения:
(NH4)2SO4 + BaCl2 . 2H2O =
= BaSO4↓ + 2NH4Cl + 2H2O
Так как вещества реагируют в химических реакциях равным числом грамм-эквивалентов, то
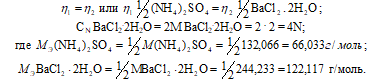
Согласно закону равенства эквивалентов:
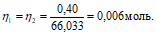
Теперь рассчитаем объём раствора (BaCl2 . 2H2O, теоретически необходимый для осаждения 0,40г (NH4)2SO4 из пропорции:
1000 : 4 = х : 0,006;
х = (0,006 . 1000)/4 = 1,5 см3.
Для полного осаждения необходимо брать полуторный избыток раствора осадителя от теоретически расчётного, т.е. объём BaCl2 . 2H2O, необходимый для осаждения:
V(BaCl2 . 2H2O) = (1,5 . 1,5) = 2,25 см3.
Условия осаждения:
Определение осложняется тем, что BaSO4 склонен к образованию очень мелких кристаллов, проходящих через поры фильтра, что затрудняет фильтрование и приводит к потерям. Поэтому в начале осаждения создают условия, обеспечивающие получение крупных кристаллов:
- медленно прибавляют осадитель, что необходимо также и для получения более чистого осадка;
- при осаждении BaSO4 к раствору добавляют небольшое количество НСl, что повышает растворимость осадка;
- повышают теммпературу раствора, что, в свою очередь, также повышает растворимость осадка.
Для обеспечения полноты осаждения в конце процесса добавляют избыток осадителя, фильтрование осадка проводят после охлаждения раствора.
Ответ: V(BaCl2 . 2H2O) = 2,25 см3.
Осаждение кристаллогидрата нитрата кальция
Задача 136.
Написать уравнения реакции осаждения, рассчитать объём осадителя, необходимый для проведения количественного осаждения, и описать условия осаждения. Исследуемое вещество Ca(NO3)2 . 6Н2О, навеска массой 0,50 г; осадитель Н2С2О4 . 2Н2О, концентрация 0,5 N.
Решение:
Схема реакции осаждения:
Ca(NO3)2 . 6Н2О + Н2С2О4 . 2Н2О =
= CaC2O4↓+ 2HNO3 + 8H2O
Так как вещества реагируют в химических реакциях равным числом грамм-эквивалентов, то
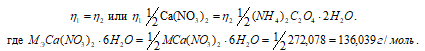
Согласно закону равенства эквивалентов:
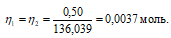
Теперь рассчитаем объём раствора Н2С2О4 . 2Н2О, теоретически необходимый для осаждения 0,40г Ca(NO3)2 . 6Н2О из пропорции:
1000 : 0,5 = х : 0,0037;
х = (0,0037 . 1000)/0,5 = 7,4 см3.
Для полного осаждения необходимо брать полуторный избыток раствора осадителя от теоретически расчётного, т.е. объём Н2С2О4 . 2Н2О, необходимый для осаждения:
V(Н2С2О4 . 2Н2О) = (1,5 . 7,4) = 11,1 см3.
Условия осаждения:
Определение осложняется тем, что CaC2O4 склонен к образованию очень мелких кристаллов, проходящих через поры фильтра, что затрудняет фильтрование и приводит к потерям. Поэтому в начале осаждения создают условия, обеспечивающие получение крупных кристаллов:
- медленно прибавляют осадитель, что необходимо также и для получения более чистого осадка;
- при осаждении CaC2O4 к раствору добавляют небольшое количество НСl, что повышает растворимость осадка;
- повышают температуру раствора, что, в свою очередь, также повышает растворимость осадка.
Для обеспечения полноты осаждения в конце процесса добавляют избыток осадителя, фильтрование осадка проводят после охлаждения раствора.
Ответ: V(Н2С2О4 . 2Н2О) = 11,1 см3.

