Проведение количественного осаждения сульфата железа (ⅠⅠⅠ) и хлорида кальция
Уравнения реакции осаждения сульфата железа (ⅠⅠⅠ)
Задача 113.
Написать уравнения реакции осаждения, рассчитать объём осадителя, необходимый для проведения количественного осаждения, и описать условия осаждения. Исследуемое вещество Fe2(SO4)3, навеска массой 0,95 г; осадитель NH4OH, концентрация 20%.
Решение:
Уравнение реакции осаждения:
Fe2(SO4)3 + 6NH4OH =
= 2Fe(OH)3↓ + 3(NH4)2SO4.
Так как вещества реагируют в химических реакциях равным числом грамм-эквивалентов, то n1 = n2.
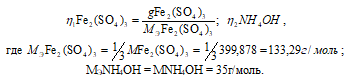
Согласно закону равенства эквивалентов:
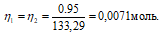
Рассчитаем массу NH4OH:
m(NH4OH) =
= М(NH4OH) . n(NH4OH) =
= (35 . 0,0071) = 0,25 г.
Теперь рассчитаем объём раствора NH4OH, теоретически необходимый для осаждения 0,95 г Fe2(SO4)3, учитывая, что плотность раствора близка к единице из пропорции:
100 : 20 = х : 0,25;
х = (0,25 . 100)/20 = 1,25 см3.
Для полного осаждения необходимо брать полуторный избыток раствора осадителя от теоретически расчётного, т.е. объём NH4OH, необходимый для осаждения:
V(NH4OH) = (1,5 . 1,25) = 1,875 см3.
Условия осаждения: Определение осложняется тем, что Fe(OH)3 - аморфное соединение, склонено к уплотнению, что затрудняет последующее отмывание осадка, кроме того при стоянни увеличивается количество примесей, адсорбированных развитой поверхностью аморфного осадка. Поэтому Fe(OH)3 отфильтровывают сразу же после осаждения и кратковременного отстаивания.
Необходимые условия осаждения:
Осаждение ведут в присутствии подходящего электролита-коагулятора (обычно это соли аммония), из нагретого анализируемого раствора нагретым раствором осадителя.
- Осаждение ведут из достаточно концентрированного исследуемого раствора концентрированным раствором осадителя.
- Медленно прибавляют осадитель, что необходимо также и для получения более чистого осадка.
- Повышают температуру раствора, что, в свою очередь, также повышает растворимость осадка.
Для обеспечения полноты осаждения в конце процесса добавляют избыток осадителя, фильтрование осадка проводят после охлаждения раствора.
Ответ: V(NH4OH) = 1,875 см3.
Уравнения реакции осаждения хлорида кальция
Задача 114.
Написать уравнения реакции осаждения, рассчитать объём осадителя, необходимый для проведения количественного осаждения, и описать условия осаждения. Исследуемое вещество CaCl2, навеска массой 1,00 г; осадитель (NH4)2C2O4, концентрация 2N.
Решение:
Уравнение реакции осаждения:
(NH4)2C2O4 + CaCl2 = CaC2O4↓ + 2NH4Cl.
Так как вещества реагируют в химических реакциях равным числом грамм-эквивалентов, то n1 = n2.
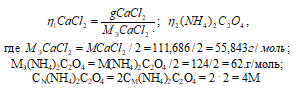
Согласно закону равенства эквивалентов:
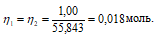
Теперь рассчитаем объём раствора (NH4)2C2O4, теоретически необходимый для осаждения 1,00 г из пропорции:
1000 : 4 = х : 0,018;
х = (0,018 . 1000)/4 = 4,5 см3.
Для полного осаждения необходимо брать полуторный избыток раствора осадителя от теоретически расчётного, т.е. объём (NH4)2C2O4, необходимый для осаждения:
V[(NH4)2C2O4] = [1,5 . 4,5] = 6,75 см3.
Условия осаждения: Определение осложняется тем, что CaC2O4 склонен к образованию очень мелких кристаллов, проходящих через поры фильтра, что затрудняет фильтрование и приводит к потерям. Поэтому в начале осаждения создают условия, обеспечивающие получение крупных кристаллов:
- медленно прибавляют осадитель, что необходимо также и для получения более чистого осадка;
- при осаждении CaC2O4 к раствору добавляют небольшое количество НСl, что повышает растворимость осадка;
- повышают температуру раствора, что, в свою очередь, также повышает растворимость осадка.
Для обеспечения полноты осаждения в конце процесса добавляют избыток осадителя, фильтрование осадка проводят после охлаждения раствора.
Ответ: V[(NH4)2C2O4] = 6,75 см3.

