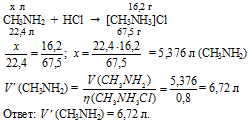"Химия. 11 класс". О.С. Габриелян (гдз)
Протолитическая (протонная) теория кислот и оснований
Вопрос 1.
Фенол является кислотой, так как в водном растворе он диссоциирует на ионы:
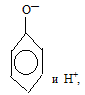
а по протолитической (протонной) теории кислот и оснований Брёнстеда и Лаури, наиболее часто применяющейся в органической химии, кислота – донор протонов, что и наблюдается при диссоциации фенола:
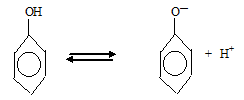
По теории Брёнстеда и Лаури основание – акцептор протонов, поэтому анилин относят к основаниям, так как он присоединяет протон в химических реакциях. Группа —ОН и группа —NH2 являются ориентантами I-го рода, поэтому активируют орто- и пара-положения в бензольном конце.
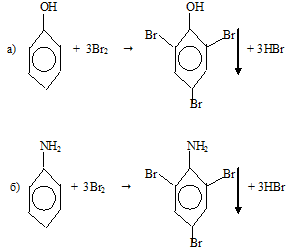
Бензол – устойчивая молекула, даже атомы водорода при обычных условиях не замещаются, но при введении в бензольное кольцо ОН-группы или NH2-группы атомы водорода легко замещаются, например, на атомы брома. Например и фенол, и анилин обесцвечивают бромную воду, при этом атомы брома замещают атомы водорода в бензольном кольце в орто- и пара-положениях.
Вопрос 2.
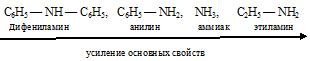
Дифениламин – очень слабое основание, так как С6Н5 — обладает –М эффектом, оттягивает на себя электронную плотность, при этом делокализуя избыточный отрицательный заряд на атоме азота (электронная плотность на атоме азота уменьшается) и снижая основные свойства (по сравнению с NH3). В молекуле анилина присутствует только один радикал фенил, поэтому здесь отрицательный заряд делокализован в меньшей степени, чем в дифениламине.
В молекуле этиламина радикал С6Н5 — обладает +I эффектом, т. е. отталкивает от себя электронную плотность, происходит локализация отрицательного заряда на атоме азота (электронная плотность на атоме азота увеличивается), что обеспечивает более активное взаимодействие с протоном, т. е. усиливает его основные свойства по сравнению с аммиаком.
На этом примере можно в очередной раз рассмотреть положении теории А. М. Бутлерова о взаимном влиянии атомов друг на друга в молекуле.
Вопрос 3.
СН4 очень устойчивая молекула, но вступает в реакции замещения с кислотами, т.е. проявляет слабые основные свойства; NH3 также проявляет основные свойства, Н2О - амфотерное вещество, НF – слабая кислота.
Вопрос 4.
NH3 – основание средней силы, РН3 – слабое основание, AsH3 - ещё более слабое основание, SbH3 – очень слабое основание, BiН3 – очень слабое основание. Так как в группе сверху вниз у атомов элементов увеличивается радиус, т.е. увеличивается длина связи Э—Н в молекуле, связь ослабляется, атомы водорода становятся более подвижными, при этом усиливаются кислотные свойства и ослабляются основные.
Вопрос 5.
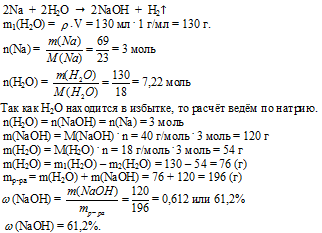
Примечание: во избежание взрыва, натрий в таких случаях лучше в вводу не бросать.
Вопрос 6.
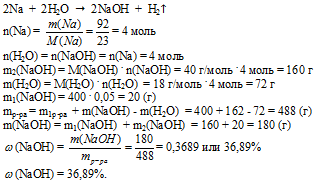
Примечание: во избежание взрыва, натрий в таких случаях лучше в вводу не бросать.
Ответ в учебнике не правильный.
Вопрос 7.