Вычисление общей жесткости воды и способы ее устранения
Устранение общей жесткости воды
Задача 1034.
Сколько карбоната натрия надо добавить к 5 л воды, чтобы устранить общую жесткость, равную 4,60 мэкв/л?
Решение:
В 5 л воды содержится 5 . 4,6 = 23 мэкв/л солей, обусловливающих жесткость воды. Для устранения жесткости воды следует прибавить 1,219 г соды (23 . 53 = 1219 мг), где
53 г/моль — молярная масса эквивалента Na2CO3.
Ответ: 1,219 г.
Вычисление жесткости воды
Задача 1035.
В 1 л воды содержится 38 мг ионов Мg2+ и 108 мг ионов Са2+. Вычислить общую жесткость воды.
Решение:
Жесткость воды выражается суммой миллиэквивалентов ионов Са2+ и Mg2+, содержащихся в 1 л воды (моль/л). Один мэкв/л жесткости отвечает содержанию 20,04 мг/л Са2+ или 12,16 мг/л Mg2+.
Находим общую жёсткость воды:
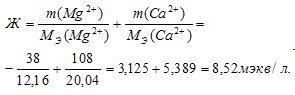
Ответ: 8.52 мэкв/л.
Задача 1036.
При кипячении 250 мл воды, содержащей гидрокарбонат кальция, выпал осадок массой 3,5 мг. Чему равна жесткость воды?
Решение:
Находим массу осадка в 1 л воды, получим:
m(CaCO3) = (1000 . 3,5)/250 = 14 мг.
Находим количество молей осадка, получим:
η(CaCO3) = m(CaCO3)/ MЭ(CaCO3) =
= 14/50 = 0,28 мэкв/л.
Ответ: 0,28 мэкв/л.
Ионообменный способ устранения жесткости воды
Задача 1037.
В чем заключается ионообменный способ устранения жесткости воды?
Решение:
Для устранения жёсткости воды методом ионного обмена воду пропускают через слой катионита. При этом катионы Са2+ и Mg2+, содержащиеся в воде, обмениваются на катионы Na+ или Н+, содержащиеся в применяемом катионите, т. е. ионы Са2+ и Mg2+ выходят из воды в ионит, а в воду выходят ионы Na+ или Н+.
Когда процесс ионного обмена доходит до равновесия, ионит перестаёт работать - утрачивает способность умягчать воду. Катионит можно регенерировать, пропуская через катионит концентрированный раствор NaCl (Na2SO4) или HCl (H2SO4). При этом ионы Са2+ и Mg2+ выходят в раствор, а катионит вновь насыщается ионами Na+ или ионами Н+.

