Определение формулы органического вещества по данным о продуктах его горения
Задача 73.
При сгорании некоторого количества углеводорода образовалось 11л углекислого газа (СО2) (н.у.) и 8,8 г воды. Определите молекулярную формулу сгоревшего вещества, если относительная плотность его паров по самому легкому углеводороду, способному к структурной изомерии и отвечающему той же простейшей формуле, что и
Дано:
объем углекислого газа (н.у.): V(СО2) = 11 л;
масса воды: m(Н2О) = 8,8 г;
относительная плотность паров сгоревшего вещества по самому легкому углеводороду, способному к структурной изомерии и отвечающему той же простейшей формуле:
Dпрост. у. н.
Найти: молекулярную формулу исходного углеводорода.
Решение:
Шаг 1 . Элементный состав искомого соединения определяется по названию. Углеводород состоит только из углерода и водорода. Обозначим его формулу как СхНу.
Шаг 2. Схема реакции горения будет выглядеть так:
СхНу + О2 → СО2 + Н2О.
Шаг 3. По схеме реакции видно, что весь углерод, содержавшийся в СхНу перешел в СО2. А весь водород из СхНу перешел в Н2О. Следовательно, достаточно будет определить количество вещества углерода в СО2 и водорода в Н2О.
1. Определение количества вещества углерода.
Используем следующий алгоритм: V(СО2) → n(СO2) → n(С)
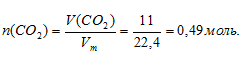
n(С) = n(СО2) = 0,49 моль (по индексам в записи формулы СО2).
2. Определение количества вещества водорода.
Используем следующий алгоритм: m(Н2О) → n(Н2О) → п(Н)
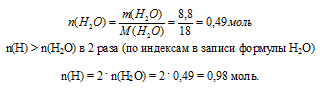
Запишем соотношение количеств веществ в искомом углеводороде:
п(С): n(Н) = 0,49: 0,98.
Шаг 4. Определяем простейшую формулу СxНy.
N(С) : N(Н) = 0,49 : 0,98
Выбираем наименьшее значение (в данном случае 0,49) и делим на него оба числа:
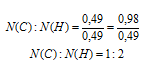
Получили набор наименьших целых чисел. Это дает возможность записать простейшую формулу: С1H2.
Шаг 5. Выявление истинной формулы.
Вещества с формулой СН2 не существует. В истинной формуле сгоревшего углеводорода индексы будут в некоторое число раз больше, чем в простейшей. Для определения, во
сколько раз необходимо увеличить индексы в простейшей формуле, необходимо определить значение истинной молярной массы искомого вещества. Для этого по данным об относительной плотности паров искомого вещества по самому легкому углеводороду, способному к структурной изомерии и отвечающему простейшей формуле С1Н2, необходимо определить истинную молярную массу сгоревшего вещества.
Самым легким углеводородом, отвечающим простейшей формуле, будет этен: Н2С=СН2. Но он не способен к структурной изомерии. Только для вещества С3Н6 можно предложить два структурных изомера: пропен и циклопропан. Следовательно, относительная плотность паров сгоревшего вещества определена по углеводороду С3Н6.
Воспользуемся соотношением:
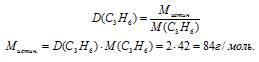
Определим значение молярной массы для простейшей формулы:
Мпрост = (1.12) + (2 .1) = 14 г/моль.
Истинная молярная масса сгоревшего вещества больше молярной массы простейшей формулы, следовательно, индексы в простейшей формуле необходимо увеличивать.
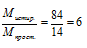
Умножаем индексы в простейшей формуле на 6 и получаем истинную формулу: С6Н12. М(С6Н12) = 84 г/моль.
По этой молекулярной формуле мы не можем определить даже класс соединений, к которому это вещество относится. Оно может быть циклоалканом или алкеном. В условии же задачи требовалось лишь определить молекулярную формулу.
Ответ: С6Н12.

