Химические свойства и способы получения муравьиного альдегида
Задача 4.
Опишите химические свойства муравьиного альдегида. Приведите промышленные и лабораторные способы получения этого соединения.
Решение:
Атом углерода в карбонильной группе находится в состоянии sp2-гибридизации и образует 3 сигма-связи (две связи С-Н и одну связь С-О). Сигма-связь образована р-электронами атомов углерода и кислорода. Двойная связь С = О является сочетанием пи- и сигма-связей. Электронная плотность смещена в сторону атома кислорода.
В молекулах альдегидов имеется несколько реакционных центров: электрофильный центр (карбонильный атом углерода), участвующий в реакциях нуклеофильного присоединения; основный центр – атом кислорода с неподеленными электронными парами; Н-С(О)-Н кислотный центр, отвечающий за реакции конденсации; связь С-Н, разрывающаяся в реакциях окисления.
Реакции присоединения
1. Присоединение водорода (восстановление):
Н-CH=O + H2 (t,Ni) → Н-CH2-OH (метиловый спирт);
2. Присоединение аммиака:
Н-CH=O + H-NH2 → Н-CH(NH2)OH;
3. Присоединение бисульфита натрия:
Н-CH=O + HSO3Na → CH3– Н-CH(OH)-SO3Na;
4. Присоединение циановодородной кислоты (синильной):
Н-CH=O + H-CN → H-CH(CN)-OH;
5. Присоединение гидразина с образованием гидразона:
Н-CH=O + 2HN-NH2 → Н-CH=N-NH2 + H2O;
6. Присоединение аминов с образованием N-замещенного имина:
Н-CH=O + H2NC6H5 → Н-CH=NC6H5 + H2O;
7. Присоединение тиола с образованием дитиоацеталя (в кислой среде):
Н-CH=O + C2H5SH → Н-CH(SC2H5)-SC2H5 + H2О;
8. Присоединение воды с образованием гем-диола:
Н-CH=O + Н-ОН → Н-CH(OH)-OH.
При действии щелочи на формалин получаются метиловый спирт и муравьиная кислота:
2Н-CH=O + Н-ОН → СН3-ОН + Н-СООН.
В присутствии щелочей в водном растворе может идти и другая реакция: формальдегид конденсируется, причем в числе прочих продуктов получается один из простейших сахаров, или гексоз:
6Н-CH=O → C6H12O6 (Реакция Бутлерова: 2Н-CH →
→ O + RbOH = -CH=O);
9. Присоединение спирта с образованием полуацеталя:
Н-CH=O + C2H5OH → Н-CH(OH)-O-C2H5.
10. При взаимодействии формальдегида с ацетальдегидом в газовой фазе в присутствии катализаторов (окись алюминия, ацетат свинца на силикагеле и др.) образуется акролеин:
Н-CH=O + СН3-СН=О → СН2=СН-СН=О.
В водном растворе при большом избытке формальдегида под влиянием гидроокиси кальция конденсация с ацетальдегидом приводит к пентаэритриту:
4Н-CH=O + СН3-СН2-СН=О → НОСН2 - С(СН2ОН)3.
Высшие алифатические альдегиды дают в этих условиях окси-или диоксиальдегиды (в зависимости от числа H-водородных атомов):
Н-CH=O + СН3-СН=О → СН3-С(СН2ОН)2-СН=О
или СН3-С(СН3)(СН2ОН)-СН=О.
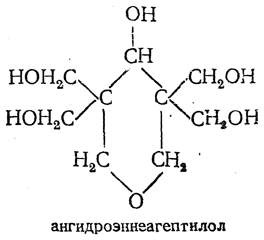
Формальдегид при взаимодействии с ацетоном образует ангидроэннеагептилол:
Реакции окисления
1. Альдегиды – довольно сильные восстановители, и поэтому легко окисляются различными окислителями, например: KMnO4, K2Cr2O7, [Ag(NH3)2]OH, Cu(OH)2. Все реакции идут при нагревании:
а) 5HCOH + 4KMnO4(изб) + 6H2SO4 →
→ 4MnSO4 + 2K2SO4 + 5CO2 + 11H2O;
б) 3СН2О + 2K2Cr2O7 + 8H2SO4 →
→ 3CO2 +2K2SO4 + 2Cr2(SO4)3 + 11H2O;
в) HCHO + 4[Ag(NH3)2]OH →
→ (NH4)2CO3 + 4Ag + 2H2O + 6NH3 или
HCHO + 2[Ag(NH3)2]OH →
→ NH4СООН + 2Ag + H2O + 3NH3;
г) HCOH + 4Cu(OH)2 → CO2 + 2Cu2O + 5H2O
Реакции полимеризации
1. Реакция с фенолом с образованием фенолформальдегидных смол:
HCOH + 2C6H5OH = HOC6H4-CH2-C6H4OH + H2O
Получение формальдегида:
Промышленные методы получения формальдегида
1. Окисление метанола.
Реакция проводится в присутствии серебряного катализатороа и при нагревании (около 650—720 °C) или при 400 °C в присутствиии железо-никилиевых катализаторов:
2СН3ОН + O2 + (kat, t°C) = H2CO + 2H2O
2. Реакция дегидрирования метанола.
Процесс проводится на цинк-медных катализаторах при 600 °C:
СН3ОН + (kat, t°C) = H2CO + Н2
3. Окисление метана.
Реакцию проводят при температуре 450 °C и давлении 1—2 МПа на катализаторе AlPO4.
СН4 + О2 = H2CO + Н2О
Лабораторные способы получения формальдегида
1. Восстановление метанола:
СН3ОН + CuO = H2CO + Cu + H2O
Реакцию проводят, опуская раскаленную медную проволоку в пробирку с метанолом, образуется резкий запах альдегида. Если процесс окисления повторить несколько раз, то можно получить значительную концентрацию формальдегида.
2. Реакция метанола с перманганатом калия:
3СН3ОН + 2KMnO4 →
→ 3H2CO + 2H2O + 2MnO2 + 2КОН
Смесь слабого раствора марганцовки и метанола нагревают до кипения. Появляется запах формальдегида, а фиолетовая окраска перманганата исчезает.
3. Реакция метанола с бихроматом калия:
3H3C-OH + К2Сг2О7 + 4H2SO4 →
→ 3HC-OH + 7H2O + K2SO4 + Cr2(SO4)3
В насыщенный раствор бихромата калия К2Сг2О7 добавляют такой же объем концентрированной серной кислоты. Затем по каплям вводят метанол. Очень осторожно подогревают смесь (отверстие пробирки направляют в сторону!). Реакция идет с выделением тепла. Желтая окраска хромовой смеси исчезает, и появляется зеленая окраска сульфата хрома.

