Химические свойства карбоната натрия
Задача 978.
Написать уравнения реакций получения из карбоната натрия: а) силиката натрия; б) ацетата натрия; в) нитрата натрия; г) гидросульфата натрия; д) сульфита натрия.
Решение:
Уравнения реакций получения:
а) получение силиката натрия
Na2CO3 +SiO2 = Na2SiO3 + CO2↑;
б) получение ацетата натрия
Na2CO3 + 2СН3СООН =
= 2СН3СООNa + H2O + CO2↑;
в) получение нитрата натрия
Na2CO3 + 2HNO3 =
= 2NaNO3 + H2O + CO2↑;
г) получение гидросульфата натрия
Na2CO3 + 2H2SO4 =
= 2NaHSO4 + H2O + CO2↑;
д) получение сульфита натрия
Na2CO3 + SO2 = Na2SO3 + CO2↑.
Задача 979.
При разложении КСlО3 получили 3,36 л кислорода (условия нормальные). Какое количество теплоты при этом выделилось?
Решение:
ΔН0(KCl) = -439,5 кДж/моль;
ΔН0 (KClO3) = -391,2 кДж/моль
Уравнение реакции:
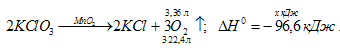
Находим ΔН0х.р., используя следствие из закона Гесса, получим:
ΔН0х.р. = 2 (KCl) - 2 (KClO3) =
= 2(-439,5) – 2(-391,2) = -96,6 кДж.
Рассчитаем количество теплоты, выделившееся при реакции из пропорции:
(3 . 22,4) : -96,6 = 3,36 : х;
х = 3,36(-96,6)/ (3 . 22,4) = -4,83 кДЖж.
Ответ: -4,83 кДж.
Задача 980.
Какой объем водорода, измеренного при 25 °С и давлении 755 мм рт. ст. (100,7 кПа), выделится при взаимодействии с водой 1 г сплава, состоящего из 30% (масс.) калия и 70% (масс.) натрия?
Решение:
Находим массу кальция и калия:
m(Nа) = 1 . 0,7 = 0,7 г;
m(K) = 1 . 0,3 = 0,3 г
Уравнения реакций:
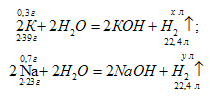
Рассчитаем объёмы водорода, выделившегося при взаимодействии калия и натрия с водой:
V(а) (2 . 39) : 22,4 = 0,3 : х;
х = (22,4 . 0,3)/ (2 . 39) = 0,086 л.
V(б) 2 . 23) : 22,4 = 0,7 : х;
х = (22,4 . 0,7)/ (2 . 23) = 0,34 л.
V(Н2) = V(a) + V(б) = 0,086 + 0,34 =
= 0,426 л или 426 мл.
Приведем объём водорода к нормальным условиям, используя объединенный закон Гей-Люссака и Бойля - Мариотта:

где V – объём газа, измеренный при давлении р и температуре Т по Кельвину; V0 – объём, измеренный при нормальных условиях.
Произведём пересчёт объёма водорода, взятого при данных условиях, на объём при нормальных условиях:
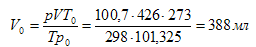
Ответ: 388 мл.

