Задаачи по химии на определение молекулярных формул веществ
Задача 106.
При сгорании 4,3 г углеводорода образовалось 13,2 г СО2. Плотность пара углеводорода по водороду равна 43. Вывести молекулярную формулу вещества.
Решение:
Находим массу углерода, содержащуюся в образце углеводорода из пропорции:
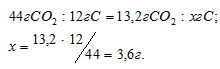
Теперь определим массу водорода, содержащуюся в образце углеводорода:
4,3 - 3,6 = 0,7 г.
Обозначим числа атомов углерода и водорода в простейшей формуле углеводорода соответственно через атомные массы углерода и водорода равны соответственно 12 и 1. Поэтому массы углерода и водорода в составе углеводорода будут относиться как 12x : 1у. По условию задачи отношение масс углерода и водорода в образце углеводорода составляет: Следовательно, значения х и у можно найти из пропорции:
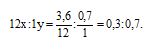
Чтобы выразить полученное отношение целыми числами, разделим оба его члена на наименьший из них:
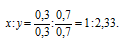
а затем умножим оба члена последнего отношения на 3, получим:
x : y = (1 . 3) : (2,33 . 3) = 3 : 7
Простейшая формула соединения будет иметь вид: С3Н7, которой отвечает молекулярная масса, равная 43. истинную молекулярную массу углеводорода находим исходя из его плотности по водороду:
M(СxНy) = D . M(H2) = 43 . 2 =86г/моль.
Находим коэффициент (n), показывающий во сколько раз истинная молекулярная масса вещества больше вычисленной:
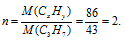
Теперь найденные значения x и y умножаем на 2, получаем: n(СxНy) = C6H14.
Истинная формула вещества будет иметь вид: C6H14.
Ответ: C6H14.
Задача 107.
При полном сгорании навески органического бромсодержащего вещества массой 1,88 г получено 0,88 г СО2 и 0,3 г Н2O. После превращения всего брома, содержавшегося в навеске, в бромид серебра, получено 3,76г AgВr. Плотность паров вещества по водороду равна 94. Определить молекулярную формулу исследуемого вещества.
Решение:
Молекулярные массы углекислого газа, воды и бромида серебра соответственно равны 44, 18 и 187,8. Массы углерода, водорода брома, входящих в состав бромосодержащего органического вещества находим по массам образовавшихся углекислого газа, воды и бромида серебра. При этом учтём, что в одном моле СО2 содержится 12 г углерода, в одном моле Н2О – 2 г водорода, а в одном моле AgBr – 79,9 г брома. Находим массы углерода, водорода и брома, содержащихся СО2, Н2О и AgBr из пропорций:
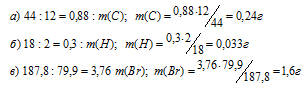
Таким образом, в сгоревшем образце бромосодержащего углеводорода содержится 0,24 г углерода, 0,033 г водорода и 1,6 г брома. Так как сумма масс этих элементов равна массе навески сгоревшего вещества (1,88 г), то кислорода в нём не содержится.
Обозначим числа атомов углерода, водорода и брома в простейшей формуле бромосодержащего углеводорода соответственно через Атомные массы углерода, водорода и брома равны соответственно 12, 1 и 79,9. Следовательно, значения можно найти из пропорции:
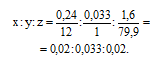
Чтобы выразить полученное отношение целыми числами, разделим все три его члена на наименьший из них:
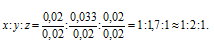
Простейшая формула соединения будет иметь вид: СН2Br, которой отвечает молекулярная масса, равная 93. Истинную молекулярную массу вещества находим исходя из его плотности по водороду:
M(СxНyBrz) = D . M(H2) =
= 94 . 2 =188г/моль.
Находим коэффициент (n), показывающий во сколько раз истинная молекулярная масса вещества больше вычисленной:
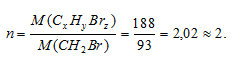
Теперь найденные значения x, y и z умножаем на 2, получаем: n(СxНyBrz) = С2Н4Br2).
Истинная формула вещества будет иметь вид: С2Н4Br2.
Ответ: С2Н4Br2.
Задача 108.
При взрыве смеси, полученной из одного объема некоторого газа и двух объемов кислорода, образуются два объема СО2 и один объем N2. Найти молекулярную формулу газа.
Решение:
Обозначим один объём газа через и запишем схему уравнения реакции с учётом данных задачи, получим:
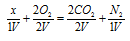
Из схемы вытекает, что газ, подвергшийся взрыву, состоит из двух атомов углерода (две молекулы СО2) и двух атомов азота (одна молекула N2). Формула будет иметь вид: С2N2. Уравнение реакции будет иметь вид:
С2N2 + 2O2 = 2CO2 + N2 .
Ответ: С2N2.
Задача 109.
Найти молекулярную формулу соединения бора с водородом, если масса 1 ч чл этого газа равна массе 1 л азота, а содержание бора в веществе составляет 78,2% (масс.).
Решение:
Известно, что один моль любого газа при нормальных условиях занимает объём 22,4 л. Молекулярная масса азота равна 28.
Так как массы соединения бора с водородом и азота равны, то можно вычислить массу 1 л этого соединения из пропорции:
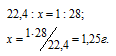
Здесь x - соединение водорода с бором.
Содержание водорода в веществе равно 21,8% (100 – 78,2 = 21,8).
Обозначим числа атомов бора и водорода в простейшей формуле исследуемого вещества соответственно через x и y. Атомные массы бора и водорода соответственно равны 10,8 и 1. Поэтому массы бора и водорода в веществе относятся как 10,8x : 1. По условию задачи отношение масс бора и водорода в исследуемом веществе равно 78,2 : 21,8. Следовательно, значения x и у можно найти из пропорции:
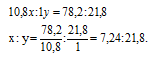
Чтобы выразить полученное отношение целыми числами, разделим оба его члена на наименьший из них:
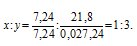
Простейшая формула соединения будет иметь вид: BH3. В обычных условиях существует гидрид бора состава B2H6.
Ответ: B2H6.
Задача 110.
Вычислить массу азота, содержащегося в 1 кг: а) калийной селитры KNO3; б) аммиачной селитры NH4NO3; в) аммофоса (NH4)2HPO4.
Решение:
а) M(KNO3) = 101,09 г/моль. Массу азота, входящую в состав 1 кг калийной селитры находим из пропорции:
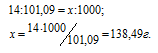
б) М(NH4NO3) = 80 г/моль. В молекуле аммиачной селитры содержится два атома азота. Массу азота, входящую в состав 1 кг аммиачной селитры находим из пропорции:
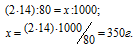
в) М[(NH4)2HPO4] = 132 г/моль. В молекуле аммофоса содержится два атома азота. Массу азота, входящую в состав 1 кг аммофоса находим из пропорции:
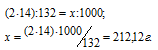
Ответ: а) 138,49 г; б) 350 г; в) 212,12 г.

