Вычисление молярной массы эквивалента, молярной и относительной атомной массы одновалентного металла
Задание 9.
В 2,48 г оксида одновалентного металла содержится 1,84 г металла. Вычислите молярную массу эквивалента металла и его оксида. Чему равна молярная и относительная атомная масса этого металла?
Решение:
Находим массу кислорода, содержащегося в оксиде металла:
2,48 – 1,84 = 0,64 г.
Следует иметь в виду:
а) молярная масса эквивалента оксида металла равна сумме молярных масс эквивалентов металла и кислорода:
б) молярная масса эквивалента кислорода равна 8 г/моль.
Согласно закону эквивалентов массы (объёмы) реагирующих веществ m1 и m2 пропорциональны их молярным массам (объёмам):
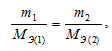
Следовательно, молярную массу эквивалента металла можно вычислить из выражения:
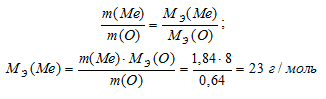
Тогда молярную массу эквивалента оксида находим из соотношения:
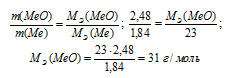
Можно вычислить и так:
MЭ(МеО) = MЭ(Ме) + MЭ(О) = 23 + 8 = 31 г/моль.
Молярная масса металла определяется из соотношения МЭ = А/В, где МЭ – молярная масса эквивалента металла;
А – молярная масса металла; В – стехиометрическая валентность элемента; А = МЭ . В = 23 . 1 = 23 г/моль.
Так как относительная атомная масса в а. е. м. численно равна относительной молярной массе, выраженной в г/моль, то искомая масса металла равна 23 а. е. м..
Ответ: МЭ(МеО) = 31 г/моль; МЭ(Ме) = 23 г/моль; М(Ме) = 23 г/моль; Ar(Ме) = 23 а. е. м..

